Профессор В.Е. Ноников
ЦКБ Медицинского центра УД Президента России, Москва
Антибактериальная химиотерапия составляет основу этиотропного лечения пневмоний. Течение и исход пневмоний во многом определяются выбором антибактериального средства для исходной терапии. Первым шагом в лечении пневмоний всегда является решение о применении антибактериальных средств, которые должны назначаться в первые два часа при пневмониях тяжелого течения, а при пневмониях тяжелого течения с различными факторами риска – немедленно.
Чтобы антибактериальная терапия была эффективной и рациональной, идеальным является назначение антимикробного препарата, наиболее активного в отношении установленного возбудителя. Для этого желательно установить этиологию или, по крайней мере, знать, какой микроорганизм наиболее вероятен, оценить аллергологический анамнез и причины неэффективности предшествующей (если она проводилась) терапии. Необходимо решить, какие антибактериальные средства предпочтительны, возможно ли проведение монотерапии, определить дозу и ритм применения препарата, а также путь применения (пероральный или парентеральный). Весьма существенна и стоимость предполагаемой терапии.
Установление вероятного возбудителя
Для установления возбудителя традиционно проводят бактериологическое исследование мокроты. Количественная оценка микрофлоры считается необходимой, так как диагностически значимыми являются концентрации более 1 млн микробных тел в 1 мл мокроты. Определение чувствительности выделенной микрофлоры к антибиотикам может быть хорошим подспорьем клиницисту, особенно в случаях, когда исходная терапия оказалась неэффективной. Результаты бактериологического исследования могут быть искажены предшествующей антибактериальной терапией. Поэтому более убедительны данные посевов мокроты, полученной до начала лечения. Наиболее доказательным является получение гемокультуры, которая может быть выделена только при пневмониях, протекающих с бактериемией. Вероятность высева гемокультуры возрастает, если посевы крови на стерильность проводятся во время ознобов. Бактериологическое исследование требует времени, и его результаты могут быть получены лишь через 34 дня.
Ориентировочным методом является микроскопия мазка мокроты, окрашенного по Граму. Эта методика общедоступна, непродолжительна по времени и может помочь при выборе антибиотика, однако при микроскопии не выявляются внутриклеточные агенты (микоплазма, хламидии, легионелла).
Проводимое лечение не влияет на результаты некультуральных исследований, которые используются для этиологической расшифровки микоплазменных, хламидийных и легионеллезных инфекций. Специфические антитела к этим возбудителям определяются с помощью реакции непрямой иммунофлюоресценции (РНИФ) или с использованием более современных методик теста ELISA (антитела к микоплазме и хламидиям) и определения антигена в моче (легионелла) [2].
Даже в условиях современного стационара лишь у половины больных пневмонией удается достоверно установить возбудитель, причем этиологическая диагностика может длиться до 10 дней (максимальные сроки выделения гемокультуры) [8]. К экспрессметодикам можно отнести лишь определение в моче антигена легионеллы, но это исследование пока не получило широкого распространения. Поэтому почти всегда выбор антибиотика первого ряда осуществляется эмпирически [2,3,4,7,8]. Врач принимает решение, основываясь на знании аллергологического анамнеза, эпидемиологической и клинической ситуации, спектра действия антибиотика.
Наиболее частыми бактериальными возбудителями внебольничных пневмоний являются пневмококки, стрептококки, гемофильные палочки. С 1970х годов объективной реальностью стало возрастание эпидемиологической значимости ранее малоизвестных агентов, таких как легионелла, микоплазма, хламидия, пневмоцисты, различные микобактерии и грибы [3,4,7,8]. Серьезной проблемой является возрастающая приобретенная резистентность к антибиотикам многих микроорганизмов.
У молодых людей пневмонии чаще вызываются моноинфекцией, а у лиц старше 60 лет ассоциациями возбудителей, 3/4 которых представлены сочетанием грамположительной и грамотрицательной флоры [3]. Частота микоплазменных и хламидийных пневмоний значительно варьирует (420%) в зависимости от эпидемиологической ситуации. Этим инфекциям более подвержены молодые люди.
Обострения хронической обструктивной болезни легких (ХОБЛ) часто вызваны пневмококками, грамотрицательными микроорганизмами (гемофильные палочки, моракселла), а также микоплазмой и хламидиями.
Выбор антибактериальных средств
При выборе антибактериальных средств следует учитывать региональные особенности приобретенной резистентности к антибиотикам. Во многом она обусловлена традициями антибактериальной терапии, доступностью препаратов и шаблонностью их применения. Анализ чувствительности к антибиотикам микроорганизмов, выделенных из мокроты больных пневмониями в Москве [3], показал частую устойчивость стрептококков (включая пневмококки) к пенициллину, ампициллину, доксициклину, эритромицину, линкомицину, котримоксазолу.
При внебольничных пневмониях обычно назначается монотерапия bлактамными антибиотиками или макролидами. Ошибки в выборе антибиотика первого ряда приводят к последующей коррекции лечения назначению антибиотиков других групп. Поэтому чаще стали применяться сочетания bлактамных антибиотиков с макролидами, что, в первую очередь, оправдано при тяжелом течении пневмонии, когда нельзя достоверно исключить легионеллез. Стремление к получению эффекта уже от начального лечения привело к формированию тактики деэскалации антибактериальной терапии, которая обычно подразумевает исходное применение сочетания антибиотиков с последующим сокращением объема проводимой терапии (в зависимости от установленного возбудителя или особенностей клинического течения болезни).
Широко применявшиеся ранее при лечении бронхолегочных инфекций офлоксацин и ципрофлоксацин обладали невысокой активностью в отношении грамположительных бактерий, прежде всего пневмококков и стрептококков, что снижало их эффективность при лечении внебольничных бронхолегочных инфекций.
В последние годы значительный интерес проявляется к фторхинолонам последних генераций, к которым относятся разрешенные к применению в России левофлоксацин, моксифлоксацин и спарфлоксацин. Эти фторхинолоны (получившие название респираторных) в отличие от фторхинолонов предшествующих генераций эффективно подавляют грамположительные микроорганизмы. Левофлоксацин (Таваник),моксифлоксацин, спарфлоксацин высоко активны [7,8,9,10] в отношении грамположительных микроорганизмов: стрептококков, пневмококков, стафилококков, листерий, коринебактерий и, в меньшей степени, способны подавлять энтерококки.
Антибактериальные препараты этой группы обладают также высокой активностью в отношении большинства грамотрицательных бактерий: гемофильных палочек, моракселлы, ацинетобактера, энтеробактера, цитробактера, гонококка. Несколько ниже их эффективность в отношении клебсиеллы, синегнойной и кишечной палочек.
Респираторные фторхинолоны высоко активны в отношении внутриклеточных микроорганизмов легионелл, микоплазм, хламидий. Они также подавляют микобактерии туберкулеза и некоторые анаэробы.
Возможный выбор антибактериальных средств в зависимости от этиологических агентов пневмоний представлен в таблице 1. Хорошо видно, что респираторные фторхинолоны активны в отношении большинства возможных возбудителей пневмоний.
Фторхинолоны новых генераций [1,5] хорошо всасываются и обладают высокой биодоступностью (левофлоксацин – до 99%, моксифлоксацин – до 92%). При этом создаются высокие концентрации препаратов в слизистой бронхов, альвеолярных макрофагах, легочной паренхиме, превышающие концентрации в сыворотке крови, что немаловажно для лечения бронхолегочных инфекций.
Левофлоксацин и моксифлоксацин обычно хорошо переносятся. Им в меньшей степени, чем другим фторхинолонам [1,5,6] свойственны гепато и фототоксичность, удлинение QT-интервала. В отношении спарфлоксацина в ряде стран существуют ограничения [6] в связи с эффектом фототоксичности. По данным J. Bartlett [7], лечение спарфлоксацином чаще сопровождается побочными эффектами, и этот препарат врачи отменяют в два раза чаще, чем левофлоксацин и моксифлоксацин. Наиболее частыми (712%) побочными эффектами фторхинолонов новой генерации являются проявления со стороны желудочнокишечного тракта (тошнота, диспепсия).
Респираторные фторхинолоны не должны назначаться лицам с указаниями на аллергию к любым хинолонам, больным эпилепсией, беременным, кормящим матерям и детям.
Существенно, что особенности фармакокинетики препаратов позволяют применять их один раз в сутки. Режимы дозирования респираторных фторхинолонов приведены в таблице 2.
Левофлоксацин (Таваник) зарегистрирован в России в парентеральной и пероральной формах, что позволяет использовать его в двух режимах терапии. При лечении внебольничных пневмоний (как амбулаторно, так и в условиях стационара) легкого и средней тяжести течения левофлоксацин назначают перорально по 500 мг 1 раз в сутки в течение 7–14 (в среднем 10) дней.
Естественно, трудно принять решение о применении перорального препарата 1 раз в сутки в случаях, когда отмечаются признаки бактериемии, нестабильной гемодинамики, дыхательной недостаточности. Поэтому при внебольничных пневмониях более тяжелого течения в условиях стационара используется режим ступенчатой терапии.
При проведении ступенчатой терапии весьма важно определить этап, когда можно осуществить переход с внутривенного введения левофлоксацина на пероральный прием. Обычно используются следующие критерии: афебрильность (или низкий субфебрилитет) на протяжении 816 часов, улучшение состояния больного, уменьшение признаков гноя в мокроте, нормализация или значительное улучшение лейкоцитарной формулы.
Моксифлоксацин применяется по 400 мг 1 раз в сутки. Эффективные сроки терапии: 10 дней при лечении внебольничных пневмоний и остром синусите, 5 дней при обострении хронического бронхита. В настоящее время проводятся клинические исследования лекарственной формы моксифлоксацина для внутривенного введения, что позволит при лечении пневмоний тяжелого течения использовать этот препарат в режиме ступенчатой терапии.
Применение антибактериальных химиопрепаратов в режиме ступенчатой терапии обеспечивает эффективную терапию, которая экономически более рентабельна по сравнению с парентеральным применением антибиотиков.
Спарфлоксацин назначается в дозировке 300 мг/сут при лечении инфекций легкого течения и по 600 мг/сут при лечении пневмоний средней тяжести. Общая продолжительность терапии 1014 дней.
Широкий спектр антибактериальной активности, высокая биодоступность, особенности фармакокинетики и распределения в органах дыхания, хорошая переносимость фторхинолонов новых генераций допускает возможность монотерапии в ситуациях, когда этиология достоверно не известна и обычно используются сочетания антибиотиков.
1. Буданов С.В., Смирнова Л.Б. Левофлоксацин (Таваник) новый хинолон III поколения. Антимикробная активность, фармакокинетика, клиническое значение. // Антибиотики и химиотерапия, 2001; 5: 318.
2. Ноников В.Е. Атипичные пневмонии // Антибиотики и химиотерапия, 2001; 6: 327
3. Ноников В.Е. Антибактериальная терапия пневмоний в стационаре // Рус. мед. журнал, 2001; 9: 923929.
4. Ноников В.Е. Внебольничные пневмонии // Справочник поликлинического врача, 2001; пилотный выпуск: 710.
5. Яковлев С.В., Мохов О.И. Моксифлоксацин препарат нового поколения фторхинолонов для лечения инфекций дыхательных путей // Инфекции и антимикробная терапия, 2000; 2: 1049.
6. Ball P., Mandell L., Niki Y., Tullotson G. Comparative Tolerability of Newer Fluoroquinolone Antibacterials // Drug Safety, 1999; 21 (5): 40721.
7. Bartlett J. Pocket Book of Infectious Disease Therapy // Lippincott Williams & Wilkins, 2000, 447 p.
8. Fein A., Grossman R., Ost. et al. Diagnosis and Management of Pneumonia and Other Respiratory Infections // Professional Communications Inc, 1999. 288 p.
9. Marrie T., Lau., Wheeler S. et al. A Controlled Trial of a Critical Pathway for Treatment of CommunityAcquired Pneumonia // JAMA, 2000; 283: 74955.
10. Perry C., Goa K. Die ambulant erworbene Pneumonie und ihre Behandlung // Dis.Management Health Outcomes, 2001; 9: 4364.
Опубликовано с разрешения администрации Русского Медицинского Журнала
источник
Респираторные фторхинолоны – расширение терапевтических возможностей в лечении респираторных инфекций
Респираторные инфекции нижних отделов дыхательных путей — пневмония и обострения хронического бронхита — являются одной из самых частых причин обращения за врачебной помощью и назначения антибиотиков. Выбирая антимикробный препарат, врач исходит из ряда
Респираторные инфекции нижних отделов дыхательных путей — пневмония и обострения хронического бронхита — являются одной из самых частых причин обращения за врачебной помощью и назначения антибиотиков. Выбирая антимикробный препарат, врач исходит из ряда критериев. К наиболее важным из них относятся эффективность и безопасность. Эффективность определяется активностью антибиотика в отношении наиболее распространенных возбудителей инфекций нижних отделов респираторного тракта. Среди возбудителей пневмонии наиболее часто встречаются пневмококки, гемофильная палочка, атипичные возбудители — хламидии и микоплазма, а при тяжелом течении — легионелла. У пожилых и стариков, больных сахарным диабетом, хронической обструктивной болезнью легких (ХОБЛ), с нарушенной функцией почек, злоупотребляющих алкоголем возрастает частота таких возбудителей, как клебсиеллы и стафилококки.
Этиология внебольничных пневмоний:
- Streptococcus (Str.) pneumoniae — 20-60%;
- Mycoplasma pneumoniae — 5-50%;
- Сhlamidia pneumoniae — 5-15%;
- Haemophilus (H.) influenzae — 3-10%;
- Бактерии семейства Enterobacteriaceae:
Klebsiella (K.) pneumoniae, Escherichia (E.) coli — 3-10%; - Staphylococcus (S.) aureus — 3-10%;
- Другие (S. pyogenes, Legionella pneumoniae).
Среди этиологических факторов при инфекционных обострениях ХОБЛ доминируют пневмококки и грамотрицательные возбудители: гемофильная палочка, моракселла катаралис. Больные ХОБЛ после стационарного лечения могут быть инфицированы госпитальной микрофлорой (клебсиелла, стафилококки, синегнойная палочка), резистентной к широко применяемым антибактериальным препаратам.
Перечислим наиболее вероятных возбудителей для определенных групп больных:
- старше 65 лет, без сопутствующих заболеваний: H. influenzae, Str. рneumoniae, Moraxella catarrhalis;
- от 65 лет и старше и/или с сопутствующими заболеваниями или обострениями > 2 раз в год: H. influenzae, Str. pneumoniae, K. pneumoniae, E. сoli;
- пациенты с бронхоэктазами, тяжелым течением ХОБЛ: K. рneumoniae, E. сoli, S. aureus, H. influenzae, Pseudomonas (P.) aeruginosa.
В последние годы наблюдается рост резистентности возбудителей респираторных инфекций. Внушает тревогу прежде всего устойчивость пневмококков к пенициллину, при этом штаммы, устойчивые к пенициллину, приобретают устойчивость и к макролидам, ко-тримоксазолу, тетрациклину, фторхинолонам (табл. 1).
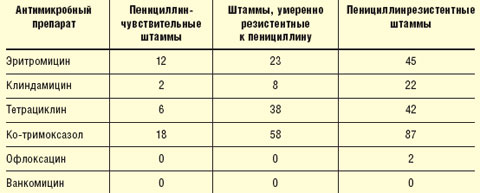 |
| Таблица 1 Перекрестная устойчивость пенициллинустойчивых пневмококков к другим антибактериальным препаратам, % (B. Murray, 1997) |
При этом от 20 до 40% штаммов гемофильной палочки продуцируют β-лактамазы, что делает их устойчивыми к действию аминопенициллинов. Следует отметить, что распространенность антибиотикорезистентности в разных странах и в разных регионах различаются. В России, по данным исследования «Пегас-1», умеренно резистентные и резистентные к пенициллину штаммы пневмококков составили 11% (Л. С. Страчунский, 2001). По данным того же исследования, резистентность гемофильной палочки к аминопенициллинам в России не представляет значительной проблемы. В то же время исследования, проведенные В. С. Сидоренко и соавт. (2001), показали, что в Москве резистентность пневмококков значительно выше — до 24%. Это еще раз подтверждает важность проведения локального мониторинга чувствительности возбудителей респираторных инфекций и формирования регионарных формулярных списков.
β-лактамные антибиотики (пенициллины, цефалоспорины) малоактивны в отношении штаммов пневмококков, резистентных к пенициллину, и не действуют на атипичных возбудителей. Значение макролидов при лечении респираторных инфекций снижается как ввиду роста резистентности пневмококков, так и недостаточной активности этих антибиотиков в отношении гемофильной палочки и отсутствия действия на микроорганизмы грамотрицательных возбудителей семейства Enterobacteriaceae. Классические фторхинолоны обладают относительно невысокой активностью в отношении пневмококков. Таким образом, рост резистентности возбудителей, увеличение ассоциаций возбудителей, особенно у больных с тяжелым течением заболевания и сопутствующей патологией (Л. А. Алексанян, 1999; А. А. Чибикова, 2005), потребовали расширения перечня препаратов для терапии респираторных инфекций.
«Новые» фторхинолоны относятся именно к таким препаратам. В чем же их отличие от «старых» фторхинолонов?
В настоящее время фторхинолоны делятся на четыре группы (классификация German Paul Ehrlich, 1998).
- Фторхинолоны, активные в отношении грамотрицательных возбудителей, с ограниченными показаниями к применению, в основном при мочевых инфекциях.
- «Классические» фторхинолоны, с широкими показаниями к применению, активные в отношении грамотрицательных, атипичных возбудителей, метициллинчувствительных стафилококков, но обладающие слабой активностью в отношении пневмококков (ципрофлоксацин, офлоксацин).
- «Новые» фторхинолоны с повышенной активностью в отношении пневмококков и атипичных возбудителей и с сохраненной активностью в отношении грамотрицательных возбудителей (левофлоксацин, спарфлоксацин).
- «Новые» фторхинолоны с повышенной активностью в отношении пневмококков и атипичных возбудителей, активностью в отношении грамотрицательных микроорганизмов и умеренной активностью в отношении анаэробных возбудителей (моксифлоксацин, гатифлоксацин).
Фторхинолоны III и IV поколений, сохраняя активность в отношении грамотрицательных возбудителей, более активны в отношении грамположительных кокков и атипичных возбудителей. In vitro они проявляют активность против метициллинрезистентных стафилококков. В связи с высокой активностью в отношении возбудителей респираторной инфекции они получили название «респираторные» фторхинолоны. В отношении P. aeruginosa они менее активны, чем ципрофлоксацин. Возбудители, устойчивые к фторхинолонам II поколения, могут быть чувствительны к фторхинолонам III–IV поколений. Фторхинолоны IV поколения умеренно активны в отношении анаэробов.
Фторхинолоны обладают быстрым бактерицидным эффектом, нарушая синтез дезоксирибонуклеиновой кислоты (ДНК) микробной клеткой путем ингибирования ферментов ДНК-гиразы и топоизомеразы IV, при этом образование ДНК в клетках организма человека не подавляется. Ингибирование функции топоизомераз приводит к необратимым изменениям в микробной клетке и ее гибели.
Фторхинолоны обладают умеренно выраженным постантибиотическим действием, под которым понимают стойкое подавление роста бактерий после ограниченного воздействия на него антимикробного препарата, при этом длительность постантибиотического эффекта зависит от вида микроорганизма и дозы [5]. Резистентность микроорганизмов к фторхинолонам развивается медленно по типу хромосомной и связана с мутациями по генам, кодирующим ДНК-гиразу или топоизомеразу IV. Уровень резистентности бывает более высоким при многоступенчатых мутациях. При этом резистентность развивается только к хинолонам. Новые фторхинолоны гораздо меньше способствуют селекции резистентных штаммов, так как чем больше активность фторхинолона по отношению к обоим ферментам, тем ниже уровень резистентности, который зависит от мутации в генах, кодирующих один фермент [6].
Эффективность антибиотика зависит также и от его фармакокинетических параметров. Всем фторхинолонам свойственны высокая биодоступность при приеме внутрь, большой объем распределения, низкое связывание с сывороточными белками, хорошее проникновение в органы, ткани и клетки организма человека, длительная циркуляция в организме, элиминация почечными и внепочечными механизмами. Биодоступность новых фторхинолонов близка к 100%; пища замедляет, но не снижает их всасываемость. Максимальная концентрация в крови достигается через 1–3 ч после приема. Они имеют большой объем распределения, создают высокие концентрации в тканях и жидкостях организма, проникают внутрь клеток, в полиморфноядерные нейтрофилы, макрофаги, альвеолярные макрофаги, где их концентрации в 2–12 раз превышают внеклеточные концентрации [7]. Респираторные фторхинолоны достигают высоких концентраций в бронхиальном секрете, что является предпосылкой для эрадикации внеклеточно расположенных возбудителей, а высокие внутриклеточные концентрации важны при пневмонии, вызванной атипичными возбудителями; они связываются с белками плазмы на 20–40%. Фторхинолоны проходят через плаценту, проникают в грудное молоко.
Препараты мало подвержены печеночному метаболизму, период полувыведения колеблется от 3–6 ч (левофлоксацин) до 10–12 ч (моксифлоксацин), что позволяет назначать их 1–2 раза в сутки. Выводятся через почки и кишечник, при этом почечная элиминация преобладает у левофлоксацина, и при нарушении функции почек период полувыведения значительно удлиняется. При тяжелой почечной недостаточности требуется коррекция доз всех фторхинолонов. При гемодиализе фторхинолоны удаляются в малой степени. С возрастом фармакокинетические параметры фторхинолонов меняются мало, поэтому коррекции доз у пациентов старших возрастных групп не требуется. В то же время у этих пациентов может быть снижена функция почек, что может привести к повышению концентрации антибиотика в крови [8].
Для фторхинолонов предиктором эффективности является отношение площади под фармакокинетической кривой к минимальной подавляющей концентрации (МПК). При лечении пневмококковой инфекции этот коэффициент должен быть более 30, а при грамотрицательных возбудителях — более 100 [9]. Этот коэффициент 30–44 — для левофлоксацина, значительно выше — для моксифлоксацина и чуть более 10 — при приеме максимальной суточной дозы ципрофлоксацина (табл. 2). Эти данные еще раз подтверждают, что ципрофлоксацин малоэффективен при инфекциях, вызванных пневмококками, и не может быть препаратом первого ряда при респираторных амбулаторных инфекциях.
 |
| Таблица 2 Отношение площади под кривой «концентрация — время (AUC)» к минимальной подавляющей концентрации для фторхинолонов (AUC/МПК90 для фторхинолонов в отношении пневмококков) |
Безопасность антибиотикотерапии определяется частотой и тяжестью развития нежелательных действий препарата и риском развития нежелательных лекарственных и диетических взаимодействий. При применении респираторных фторхинолонов нежелательные эффекты развиваются нечасто. В большинстве случаев это проявления диспепсии (тошнота, рвота, диарея); могут отмечаться головная боль, головокружения, нарушения сна. У пожилых и старых людей, особенно на фоне приема системных глюкокортикостероидов, существует риск разрыва сухожилий. Может отмечаться преходящее повышение активности печеночных ферментов. В единичных случаях описано развитие анафилактического шока, судорожного синдрома. Риск развития артропатий ограничивает их применение у беременных и кормящих, а также у детей.
Антацидные препараты, содержащие алюминий и магний, снижают всасывание фторхинолонов из желудочно-кишечного тракта, поэтому перерыв во времени между приемом антацида и антибиотика должен составлять не менее 2 ч. Не отмечено взаимодействия с ферментной системой цитохрома Р450 [9].
Эффективность антибиотикотерапии во многом зависит от соблюдения пациентом режима терапии, от того, насколько он следует рекомендациям врача. Сложность режима приема препарата (связь с приемом пищи, частота приема, количество препаратов), нежелательные действия (в том числе легкие, которые, по мнению врача, не требуют отмены препарата) могут спровоцировать больного на прекращение лечения. Как показали результаты фармакоэпидемиологического исследования, примерно 50% взрослых прекращали антибактериальную терапию преждевременно, а более 10% не следовали рекомендуемому режиму дозирования. Среди родителей 18,7% заканчивали антибактериальную терапию у детей преждевременно (не придерживались рекомендуемого врачом курса). Таким образом, результаты проведенного исследования показали, что взрослое население характеризируется неудовлетворительной комплаентностью в отношении рекомендуемой длительности курса антибактериальной терапии [10]. При проведении исследования по оценке сравнительной эффективности коротких (5-дневных) курсов левофлоксацина и 7-дневных было показано, что эффективность первых курсов не отличается от последних: при обоих режимах лечения отмечалась равная клиническая и микробиологическая эффективность [11]. С этих позиций респираторные фторхинолоны, которые можно принимать однократно в сутки, независимо от приема пищи и короткими курсами, имеют преимущества перед многими другими антибактериальными препаратами и их назначение повышает комплаентность пациентов.
Наличие форм для парентерального и перорального введения повышают удобство использования препаратов и делают возможным их использование в режиме ступенчатой терапии.
Клиническая, бактериологическая эффективность и безопасность респираторных фторхинолонов была оценена во многих многоцентровых клинических исследованиях. Так, по данным метаанализа пяти клинических исследований, прием моксифлоксацина в дозе 400 мг 1 раз в сутки при респираторных инфекциях по клинической эффективности не отличался от амоксициллина в дозе 1000 мг 3 раза в сутки и кларитромицина в дозе 500 мг 2 раза в сутки. Бактериологическая эффективность моксифлоксацина была выше и составила 94%. При использовании левофлоксацина при лечении пациентов с пневмонией препарат применяли в суточной дозе 500 мг. В исследование включили 68 больных; у 26 была пневмония тяжелого течения — у них левофлоксацин применяли в режиме ступенчатой терапии. Клиническая и бактериологическая эффективность препарата составила 100%. Только в одном случае (1,4%) потребовалась его отмена из-за преходящих нарушений психики [12]. В исследовании C. Fogarty et al. (1999) эффективность и безопасность терапии моксифлоксацином в дозе 400 мг в сутки в течение 10 дней сравнивали с эффективностью и безопасностью кларитромицина в дозе 500 мг в сутки в течение 10 дней. В исследование были включены 382 пациента с внебольничной пневмонией. Оба препарата оказались сопоставимы как по эффективности, так и по частоте развития нежелательных действий. Эффективность лечения составила 95%. В исследование по сравнению эффективности моксифлоксацина и кларитромицина у больных ХОБЛ были включены 750 пациентов (R. Wilson et al., 1999). Пациенты получали моксифлоксацин в дозе 400 мг/сут в течение 5 дней или кларитромицин в дозе 500 мг 2 раза в сутки в течение 7 дней. Клиническое выздоровление отмечалось у 89% пациентов, получавших моксифлоксацин, и у 88% пациентов, принимавших кларитромицин. Через месяц после окончания курса терапии клиническая эффективность подтверждена у 89% пациентов обеих групп. При этом бактериологическая эффективность моксифлоксацина была достоверно выше: 77,4 и 62,3% соответственно. Российские авторы сравнивали эффективность лечения обострения хронического бронхита левофлоксацином в дозе 500 мг/сут в течение 7 дней и цефуроксим аксетилом в дозе 250 мг 2 раза в сутки в течение 10 дней. Клиническая эффективность препаратов не отличалась и составила 92% в обеих группах, тогда как бактериологическая эффективность была выше в группе принимавших левофлоксацин и составила 94% против 87% в группе лечения цефуроксим аксетилом [14].
В заключение следует отметить, что респираторные фторхинолоны высокоактивны в отношении наиболее распространенных возбудителей пневмонии и обострения хронического бронхита, в том числе штаммов, устойчивых к β-лактамам, макролидам. Препараты обладают высокой биодоступностью при приеме внутрь, быстро всасываются, создают высокие концентрации в легочной ткани, бронхолегочном секрете, в клетках организма человека. Они обладают длительным периодом полувыведения, что позволяет принимать их 1–2 раза в сутки, выпускаются в виде форм для парентерального и перорального приема, что дает возможность использовать их в режиме ступенчатой терапии. Эффективность коротких 5-дневных курсов сопоставима с эффективностью более длительных курсов антибактериальной терапии. Препараты хорошо переносятся, обладают минимальным количеством нежелательных лекарственных и диетических взаимодействий.
По вопросам литературы обращайтесь в редакцию.
Е. А. Прохорович, доктор медицинских наук, профессор
МГМСУ, Москва
источник
Опубликовано в журнале:
Клиническая микробиология и антимикробная химиотерапия № 3, Том 3, 2001
Л.С. Страчунский, В.А. Кречиков
НИИ антимикробной химиотерапии, Смоленск, Россия
Контактный адрес: Владимир Анатольевич Кречиков
214019, Россия, Смоленск, а/я 5, Факс: (0812)61-12-94, Эл. почта: zvall @ antibiotic . ru
Моксифлоксацин — новый 8-метоксихинолон широкого спектра действия с высокой активностью в отношении грам(+) и грам(-) аэробной микрофлоры, анаэробов и внутриклеточных возбудителей. Он обладает также активностью против микроорганизмов, резистентных к другим классам антибактериальных препаратов, включая макролидо- и пенициллинорезистентные пневмококки и b-лактамазопродуцирующие штаммы Haemophilus influenzae. В контролируемых клинических исследованиях были продемонстрированы высокая эффективность и безопасность моксифлоксацина при внебольничной пневмонии, обострениях хронического бронхита, синусите, инфекциях кожи, мягких тканей, органов малого таза.
В статье представлен обзор результатов микробиологических и клинических исследований действия моксифлоксацина.
Ключевые слова: Моксифлоксацин, фторхинолоны, респираторные инфекции.
Moxif loxacin — the New Fluoroquinolon with Broad Spectrum of Activity
(The Literature Review)
L.S. Stratchounski, V.A. Kretchikov
Research Institute of Antimicrobial Chemotherapy, Smolensk, Russia Moxifloxacin — new broad spectrum 8-methoxyquinolon with high activity against Gram(+) and Gram(-) microorganisms as well as against anaerobes and intracellular pathogens. It is also active against microorganisms that are resistant to other classes of antimicrobials, including penicillin- and macrolide-resistant pneumococci and b-lactamase-producing Haemophilus influenzae. In the controlled clinical trials the high clinical efficacy and safety of moxifloxacin have been demonstrated for community-acquired pneumonia, exacerbation of chronic bronchitis, acute sinusitis, skin and soft tissue infections, pelvic inflammatory diseases.
In the article the literature review of microbiological studies and clinical trials on moxifloxacin is presented.
Key words: moxifloxacin, fluoroquinolones, respiratory tract infections.
Когда появились первые хинолоны, никто не ожидал, что их ждет такое блестящее будущее: из небольшой группы препаратов, использовавшихся для лечения инфекций мочевыводящих путей (МВП), они превратились в один из доминирующих классов антибиотиков.
На протяжении более 20 лет налидиксовая кислота и ее производные использовались только для лечения инфекций МВП. Вторая волна развития хинолонов связана с появлением фторированных соединений с гораздо более высокой активностью в отношении широкого спектра грамотрицательных микроорганизмов, некоторых грамположительных возбудителей (Staphylococcus aureus), улучшенной фармакокинетикой, появлением форм для парентерального введения и вследствие этого расширением показаний для применения.
«Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций. К недостаткам препаратов этого поколения следует отнести низкую активность в отношении пневмококков, хламидий, микоплазм и анаэробов. Эти недостатки преодолены при разработке новых фторхинолонов III-IV поколений (табл. 1). Одним из первых препаратов этой группы был левофлоксацин, активность которого против пневмококков и атипичных возбудителей превосходила предыдущие фторхинолоны.
Таблица 1. Классификация хинолонов/фторхинолонов [1, с дополнениями]
| Поколение | Препарат | Спектр активности |
| I — нефторированные хинолоны | Налидиксовая кислота Оксолиновая кислота Пипемидовая кислота | В основном грам(-) микрофлора (семейство Enterobacteriaceae) |
| II — «грамотрицательные» фторхинолоны | Норфлоксацин Ципрофлоксацин Пефлоксацин Офлоксацин Ломефлоксацин | Грам(-) микрофлора, S. aureus, низкая активность против Streptococcus pneumonias, Mycoplasma pneumoniae, Chlarnydophila pneumoniae |
| III — «респираторные» фторхинолоны | Левофлоксацин Спарфлоксацин Темафлоксацин * | t Активность против Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlarnydophila pneumoniae |
| IV — «респираторные» + «антианаэробные» фторхинолоны | Тровафлоксацин * Клинафлоксацин * Моксифлоксацин Гемифлоксацин ** BMS-284756** | t Активность против Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlarnydophila pneumoniae, анаэробов |
* Отозван с рынка.
** На стадии клинических испытаний.
Дальнейшие модификации химической структуры привели к появлению соединений, активных и в отношении анаэробов. Однако многие из вновь разработанных препаратов не достигли пациентов или были быстро отозваны с рынка вследствие развития тяжелых нежелательных реакций. Одним из новых препаратов, который стал успешно применяться, явился моксифлоксацин — представитель IV поколения фторхинолонов.
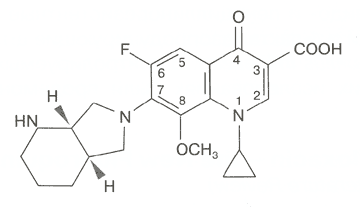
Наиболее важными в молекуле фторхинолонов, отвечающими за их антимикробные свойства, являются группы, занимающие позиции 1, 7 и 8. Циклопропиловая группа в положении 1 обеспечивает активность против грамотрицательных микроорганизмов (рис. 1). Присоединение дополнительного кольца в позиции 7 придает высокую активность по отношению к грамположительной микрофлоре, включая пневмококки. Добавление в структуру молекулы метоксигруппы в положении 8 привело к повышению активности в отношении анаэробов без увеличения риска потенциальной фототоксичности [3].
1-Циклопропил-7[(3,3)-2,8-диаза-бицикло(4.3.0)-8-ил]-6-фтор-1,4-дигидро-4-оксо-3-хинолонкарбоновой кислоты гидрохлорид
Рис. 1. Химическая структура моксифлоксацина [2]
Механизм действия
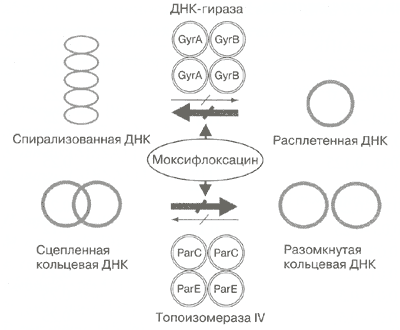
Моксифлоксацин, как и все фторхинолоны, действует бактерицидно благодаря ингибированию ферментов класса топоизомераз — ДНК-гиразы (топоизомеразы II) и топоизомеразы IV (рис. 2). Эти ферменты выполняют строго определенные функции в процессе формирования пространственной структуры молекулы ДНК при ее репликации: ДНК-гираза катализирует расплетение (отрицательную суперспирализацию) нитей ДНК, а топоизомераза IV участвует в разъединении (декатенации) ковалентно-замкнутых кольцевых молекул ДНК. Ингибирование этих ферментов нарушает процессы роста и деления бактериальной клетки, что приводит к ее гибели.
Основной мишенью моксифлоксацина в грам-положительных микроорганизмах преимущественно является топоизомераза IV, а в грамотрицательных — ДНК-гираза [4].
Рис. 2. Механизм действия моксифлоксацина
Механизмы резистентнсти
Развитие резистентности связано с мутациями в генах gyrA и gyrB (кодируют ДНК-гиразу), parС (grlA) и parЕ (grlB) — кодируют топоизомеразу IV, а также в гене norA(кодирует мембранные белки, которые участвуют в активном выбросе — эффлюксе — фторхинолонов из клетки) [5]. Высокий уровень резистентности возникает вследствие сочетания этих механизмов [6].
Мутации, возникающие в генах gyrA, gyrB, parC и parE, значительно меньше влияют на активность моксифлоксацина, чем других фторхинолонов. Например, мутации у S.aureus в генах, кодирующих топоизомеразы, меньше снижают активность моксифлоксацина, чем ципрофлоксацина, офлоксацина, левофлоксацина, спарфлоксацина.
| 1 В данной работе степень влияния мутаций gyrA и рагС на чувствительность Е. coli к фторхинолонам оценивалось как IC50 — концентрация фторхинолона, подавляющая активность фермента на 50%. |
У Escherichia coli двойная мутация гена gyrA приводит к снижению IC50 1 норфлоксацина, ципрофлоксацина и спарфлоксацина по сравнению с таковой у немутировавшего типа более чем в 500 раз, в то время как для моксифлоксацина этот показатель не превышает 12 раз [7, 8].
Эффлюкс (мутация в гене norА) значительно меньше влияет на активность гидрофобных препаратов, таких, как моксифлоксацин, по сравнению с таковой у гидрофильных препаратов, например у ципрофлоксацина [7].
При применении моксифлоксацина вероятность развития резистентности у грамположительных микроорганизмов, возможно, ниже, чем при применении других фторхинолонов, что связано с его высоким сродством как к топоизомеразе IV, так и к ДНК-гиразе [5, 8].
Спектр активности
Моксифлоксацин обладает высокой активностью против грамположительных и грамотрицательных микроорганизмов (включая микроорганизмы, устойчивые к другим классам антибиотиков), анаэробов и атипичных возбудителей.
Грамположительные микроорганизмы
Streptococcus pneumoniae
Моксифлоксацин высокоактивен в отношении S. pneumoniae. По данным одного из самых больших исследований [9], включавшем 5640 штаммов, 99,8% из них были чувствительны к препарату, 0,1% — умеренно резистентны, 0,1% — резистентны; МПК9осоставила 0,25 мг/л (табл. 2). Моксифлоксацин обладает также высокой активностью в отношении полирезистентных пневмококков: МПК90 моксифлоксацина для 138 штаммов, устойчивых к пенициллину, эритромицину и тетрациклину, составила 0,5 мг/л [14].
Таблица 2. Активность моксифлоксацина in vitro против 5. pneumoniae, мг/л
| Авторы [ссылка] | S. pneumoniae | Диапазон МПК | МПК50 | МПК90 |
| М. Jones et al. [9] | Пен-Ч (n=3603) | |||
| Пневмококки: Пен-Ч — пенициллиночувствителъные, Пен-УР — умеренно-резистентные к пенициллину, Пен-Р — пенициллинорезистентные. *НД — нет данных. | ||||
По активности в отношении пневмококка моксифлоксацин превосходит другие фторхинолоны (за исключением ситафлоксацина и гемифлоксацина): он в 2 раза активнее спарфлоксацина [9] и гатифлоксацина [15], в 4-8 раз — левофлоксацина [9, 12], в 8 раз — ципрофлоксацина и офлоксацина [12].
По сравнению с b-лактамами и макролидами активность моксифлоксацина в отношении полирезистентных S. pneumoniae значительно выше (табл. 3) [9].
Таблица 3. Сравнительная активность моксифлоксацина in vitro против S. pneumoniae, мг/л (и=5640) [9]
Пневмококки: Пен-Ч — пенициллиночувствительные, Пен-Р — пенициллинорезистентные.
Streptococcus pyogenes
Значение МПК90 моксифлоксацина для S. pyogenes (b-гемолитический стрептококк группы А) составляет 0,06-0,25 мг/л. Моксифлоксацин в 2-4 раза активнее офлоксацина, ципрофлоксацина и левофлоксацина, обладает одинаковой активностью с гатифлоксацином [16, 17]. Наличие резистентности к макролидам не влияет на активность моксифлоксацина [17].
Staphylococcus aureus
Для метициллиночувствительных 5. aureus (MSSA) МПК90 моксифлоксацина находится в диапазоне 0,06-0,125 мг/л, в то время как для метициллинорезистентных штаммов (MRSA) МПК90, по данным разных авторов, значительно различается — от 0,06 до 8 мг/л [18]. По российским данным, МПК90 моксифлоксацина для MRSA составила 0,125 мг/л, а диапазон МПК — 0,015-2 мг/л [19].
Моксифлоксацин в 8 раз активнее ципрофлоксацина и в 2-4 раза — левофлоксацина против MSSA [16, 18]. По данным M.Jones и соавт., моксифлоксацин является одним из самых активных в отношении стафилококков фторхинолоном: МПК90 моксифлоксацина для MRSA, резистентных к ципрофлоксацину, составила 2 мг/л, что было равно МПКЭО ванкомицина [18].
Грамотрицательные микроорганизмы (табл. 4)
| Микроорганизм [ссылка] | Диапазон МПК | МПК90 |
| Грамположительные микроорганизмы | ||
| S. pneumoniae [9] | 32 | |
Haemophilus influenzae, Moraxella catarrhalis
Моксифлоксацин имеет очень высокую активность в отношении Н. influenzae и М. catarrhalis, включая штаммы, резистентные к аминопенициллинам, вследствие продукции b-лактамаз.
Escherichia coli
Как и все другие фторхинолоны, моксифлоксацин обладает высокой активностью по отношению к E. coli, при этом несколько уступая ципрофлоксацину, что, однако, не имеет клинического значения [20,21].
Klebsiella spp.
Моксифлоксацин более активен, чем b-лактамные антибиотики (амоксициллин/клавуланат, цефуроксим), близок по активности к офлоксацину и незначительно уступает ципрофлоксацину [20, 21]. На штаммы E. coli и К. pneumoniae, продуцирующие ESBL и резистентные к ципрофлоксацину, Моксифлоксацин не действует [22].
Neisseria gonorrhoeae
Для моксифлоксацина характерна очень высокая активность против N. gonorrhoeae, которая несколько ниже, чем у ципрофлоксацина [21].
Pseudomonas aeruginosa
Моксифлоксацин уступает ципрофлоксацину по активности против синегнойной палочки. МПК90 моксифлоксацина, по данным разных авторов, находится в диапазоне от 8 до 32 мг/л и более, а МПК90 ципрофлоксацина — от 0,5 до 16 мг/л [15, 20,21].
Внутриклеточные возбудители (табл. 5)
В отношении С. trachomatis моксифлоксацин превосходит не только эритромицин, азитромицин, доксициклин и ципрофлоксацин, но и офлоксацин, что открывает перспективы для его применения в лечении урогенитальных инфекций.
По активности против С. pneumoniae моксифлоксацин находится на одном уровне с левофлоксацином и более активен по сравнению с ципрофлоксацином.
Mycoplasma pneumoniae
Моксифлоксацин обладает большей активностью, чем тетрациклин (МПК90 = 0,25 мг/л), доксициклин, ципрофлоксацин и левофлоксацин, однако уступает кларитромицину и азитромицину [27, 28].
Mycoplasma hominis
По активности против M. hominis моксифлоксацин значительно превосходит доксициклин, кларитромицин, левофлоксацин и ципрофлоксацин [28,30].
Ureaplasma urealyticum
Моксифлоксацин незначительно уступает кларитромицину и проявляет высокую активность как в отношении чувствительных (МПК90 — 0,25 мг/л), так и резистентных к доксициклину штаммов (МПК90 — 0,5 мг/л). Моксифлоксацин активнее доксициклина, эритромицина, ципрофлоксацина и левофлоксацина [28, 30].
Legionella spp.
Моксифлоксацин превосходит по активности ципрофлоксацин и такой классический антибиотик для лечения легионеллезной инфекции, как эритромицин, но несколько уступает кларитромицину и рифампицину [31, 32].
Таблица 5. Активность моксифлоксацина в отношении внутриклеточных возбудителей, МПК90, мг/л
| Микроорганизм | Мокси- флоксацин | Лево- флоксацин | Ципро- флоксацин | Азитро- мицин | Кларитро- мицин | Эритро- мицин | Докси- циклин | Ссылка |
| С. trachomatis | 0,06 | — | 1-2 | 0,06-0,125 | 0,015 | 0,25-0,5 | 0,25 | 21, 24, 26 |
| С. pneumoniae | 0,06-1 | 1 | 1-2 | 0,125-0,25 | 0,06 | 0,125 | 0,25 | 23, 24, 25 |
| M. pneumoniae | 0,063-0,125 | 0,5 | 1 | 32 | >16 | 4-16 | 28,30 | |
| U. urealyticum | 0,25 | 1 | 4 | — | 0,12 | 8 | 0,5-1 | 28,30 |
| Legionella spp. | 0,016-0,06 | 0,016-0,03 | 0,06 | 0,5 | 0,004 | 0,12-0,5 | 8 | 31,32 |
Mycobacterium spp. (табл. 6)
Моксифлоксацин активен в отношении как чувствительных, так и полирезистентных штаммов M. tuberculosis и превосходит ципрофлоксацин, офлоксацин и левофлоксацин. МПК90 моксифлоксацина для полирезистентных штаммов составляет 0,5 мг/л [33, 34].
По отношению к атипичным микобактериям (М. kansasii, М. avium-intracettulare) моксифлоксацин превосходит ципрофлоксацин и левофлоксацин [33].
Таблица 6. Активность моксифлоксацина в отношении микобактерий, МПК90, мг/л
| Микроорганизм | Моксифлоксацин | Ципрофлоксацин | Офлоксацин | Левофлоксацин | Изониазид | Ссылка |
| М. tuberculosis | 0,25 | 0,5 | 0,5 | >0,25 | 0,1 | 33,34 |
| М. kansasii | 0,06 | 1 | — | 0,5 | — | 33 |
| М. avium-intracellulare | 1 | 4 | _ | 4 | _ | 33 |
Анаэробы (табл. 7)
В отличие от фторхинолонов II-III поколений (ципрофлоксацина, офлоксацина, левофлоксацина) моксифлоксацин обладает высокой активностью против анаэробов (как неспорообразующих, так и спорообразующих). По антианаэробной активности моксифлоксацин сравним с имипенемом, метронидазолом и клиндамицином [35, 36].
препарата в плазме (Стах) и площади под фармакокинетической кривой (ПФК) незначительно больше, чем при приеме 400 мг внутрь [38, 40].
Максимальная концентрация препарата в плазме (Стах) в исследовании Н. Stass и соавт. [38, 39] составила 2,5 мг/л через 2 ч после приема внутрь 400 мг. В то же время в исследованиях R. Wise и соавт. [40] и A. Lubasch и соавт. [41] максимальная концентрация была 4,34-4,98 мг/л и достигалась через 1 ч. Прием пищи, включая молочные продукты, не влияет на всасывание моксифлоксацина [42,43].
Таблица 7. Активность моксифлоксацина в отношении анаэробов, мг/л [35, 36]
| Микроорганизм | Диапазон МПК | МПК90 |
| Анаэробные грамположительные кокки | 0,008-2,0 | 0,25 |
| Bacteroides fragilis | 0,125-2,0 | 0,5 |
| Fusobacterium spp. | 0,032-4,0 | 1,0 |
| Clostridium perfringens | 0,25-0,5 | 0,5 |
| Clostridium difficile | 1,0-2,0 | 2,0 |
Постантибиотический эффект
Фторхинолоны обладают выраженным постантибиотическим эффектом (ПАЭ) против грамположительных и грамотрицательных микроорганизмов, который в среднем равен 2 ч.
ПАЭ моксифлоксацина для разных микроорганизмов составляет 1,2-3,1 ч при концентрации, равной 4хМПК, и увеличивается с возрастанием концентрации препарата. Например, ПАЭ для 5. рneumoniae равно 2,2 ч при концентрации препарата 4хМПК и возрастает до 2,7 ч при его концентрации 10хМПК[37].
Фармакокинетика
Моксифлоксацин практически полностью всасывается из желудочно-кишечного тракта при приеме внутрь. Биодоступность составляет от 86 [38] до 91,8% [39]. При внутривенном введении 400 мг в течение 1 ч значения максимальной концентрации
Распределение
При приеме внутрь моксифлоксацин имеет большой объем распределения (Vd): 3,08-3,55 л/кг [2, 38] и достигает высоких концентраций в тканях и жидкостях организма: в бронхиальном секрете, альвеолярных макрофагах, тканях верхнечелюстной пазухи и жидкости, покрывающей эпителий бронхов (табл. 8).
Концентрация моксифлоксацина в жидкостях дыхательных путей значительно превышает МПК90 для основных возбудителей респираторных инфекций (табл. 4, 5).
Моксифлоксацин связывается с белками плазмы на 39,4-48%, что несколько выше, чем у ципрофлоксацина (35%) [2, 38].
Таблица 8. Концентрация моксифлоксацина в жидкостях и тканях организма*
| Локус [ссылка] | Максимальная концентрация (соотношение ткань / плазма) | Концентрация через 24 ч (соотношение ткань / плазма) |
| Слизистая оболочка верхнечелюстной пазухи [44] | 7,47 мг/кг (1,9) | 1,47 мг/кг (2,5) |
| Бронхиальный секрет [45] | 5,4 мг/кг (1,7) | 1,1 мг/кг (2,1) |
| Альвеолярные макрофаги [45] | 56,7 мг/л( 18,6) | 35,9 мг/л (70,0) |
| Жидкость, покрывающая эпителий бронхов [45] | 20,7 мг/л (6,8) | 3,6 мг/л (1,4) |
* После приема 400 мг препарата внутрь.
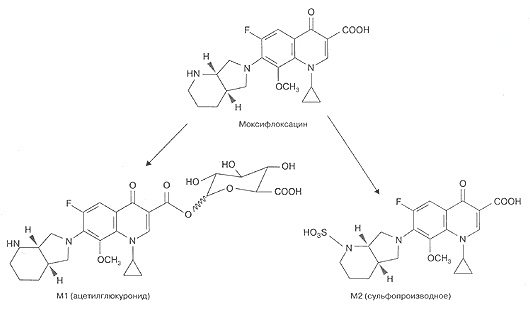
Моксифлоксацин метаболизируется в печени путем конъюгации с образованием двух метаболитов: M1 (ацетилглюкуронид) и М2 (сульфопроизводное моксифлоксацина). M1 имеет высокую степень связывания с белками плазмы (89,5%), а М2 практически не связывается — 4,8% (рис. 3) [38].
Рис. 3. Метаболизм моксифлоксацина в печени [38]
При однократном приеме 400 мг моксифлоксацина внутрь более 96% дозы выводится через почки и желудочно-кишечный тракт, при этом с мочой экскретируется 15,1-35,4% препарата [2, 38, 40]. В неизмененном виде через почки выводится 19,4% дозы; метаболита Ml — 2,5% и в виде метаболита М2 — 13,6%. С фекалиями в неизмененном виде выводится 25,4% дозы и 35,5% — в виде метаболита Ml.
По данным большинства авторов, период полувыведения составляет 12-13 ч, что больше, чем у ципрофлоксацина, офлоксацина и левофлоксацина. Длительный период полувыведения позволяет принимать препарат 1 раз в сутки в отличие от большинства фторхинолонов II поколения [2, 38, 40, 41]. Другие фармакокинетические параметры приведены в табл. 9.
Таблица 9. Фармакокинетические свойства моксифлоксацина
| Авторы [ссылка] | Количество пациентов | Путь введения * | Тmax, ч | Cmax, мг/л | ПФК,, мг/(л-ч) | Vd, л/кг | CL, л/ч | Кларитро, л/ч | Т1/2, ч |
| Н. Stass, | 12 | Внутрь | 2,0 | 2,50 | 29,8 | 3,08 | 11,6 | 2,58 | 15,6 |
| D. Kubitza [38] | Внутривенно | 1,0 | 3,62 | 34,6 | 2,05 | 11,6 | 2,61 | 15,4 | |
| R. Wise et al. [40] | 8 | Внутрь | 1,0 | 4,98 | 45,49 | — | 8,87 | 1,34 | 8,32 |
| Внутривенно | — | 5,09 | 45,34 | — | 9,09 | 1,38 | 8,17 | ||
| H. Stass et al. [2] | 7 | Внутрь | 1,50 | 2,50 | 26,90 | 3,55 | 14,90 | 3,03 | 13,1 |
| A. Lubasch et al. [41] | 12 | Внутрь | 1,02 | 4,34 | 39,3 | — | — | 1,83 | 9,15 |
* Препарат вводился однократно в дозе 400 мг.
Сmax — максимальная концентрация в плазме,
Тmax„ — время достижения Сmax,
ПФК — площадь под фармакокинетической кривой,
Vd — объем распределения,
CL — клиренс препарата из плазмы,
Кларитро — почечный клиренс,
Т1/2 — период полувыведения.
Влияние возраста, заболеваний печени и почек
У взрослых возраст практически не влияет на фармакокинетические свойства моксифлоксацина, но значения максимальной концентрации препарата в плазме и ПФК несколько выше у пожилых женщин по сравнению с таковыми у молодых и пожилых мужчин [46].
В отличие от офлоксацина и левофлоксацина при легкой почечной недостаточности — клиренс креатинина >30 мл/(мин-1,73 м 2 ) — период полувыведения остается неизменным и составляет 14,5 ч [47]. Однако пока нет достаточной информации о применении моксифлоксацина при клиренсе креатинина 2 ) или при гемодиализе, поэтому препарат не следует назначать этим категориям пациентов.
У пациентов с легкой и среднетяжелой печеночной недостаточностью (n=8) значения Сmax, ПФК и Т1/2 оказались меньше, чем у здоровых добровольцев (n=10): Сmax — 2,55 и 3,02 мг/л, ПФК — 25,1 и 32,8 мг/(л-ч), Т1/2 — 11,7 и 13,4 ч соответственно [48]. В целом пока мало данных о применении моксифлоксацина у пациентов с печеночной недостаточностью.
Как видно из данных табл. 9, нет существенных различий между фармакокинетическими параметрами при приеме моксифлоксацина внутрь и при внутривенном введении. Это позволит при появлении на рынке формы для парентерального введения использовать моксифлоксацин в ступенчатой терапии с ранним переходом на прием препарата внутрь.
Фармакодинамика
В настоящее время все большее внимание уделяется фармакодинамическим свойствам антибиотиков, которые значительно влияют на их эффективность. Считается, что для фторхинолонов условиями эффективности являются значения отношений [49, 50]:
По результатам in vitro моделирования с использованием респираторных патогенов, значения ПФК/МПК и ПФК/МПКнесвяз, для моксифлоксацина выше, чем для других фторхинолонов (табл. 10).
Таблица 10. Фармакодинамические свойства моксифлоксацина* [49]
| Антибиотик | Доза МПК, мг/л | ПФК/МПК | ПФК/МПКнесвяз |
| Ципрофлоксацин | 500 мг 2 раза в сутки 2 | 10 | 7 |
| Ципрофлоксацин | 750 мг 2 раза в сутки 2 | 14 | 10 |
| Левофлоксацин | 500 мг 1 раз в сутки 1 | 50 | 35 |
| Моксифлоксацин | 400 мг 1 раз в сутки 0,25 | 120 | 60 |
*Данные получены в модели in vitro с использованием полирезистентных штаммов S. pneumoniae.
Клиническое применение
Моксифлоксацин изучался при заболеваниях дыхательных путей (внебольничная пневмония, обострение хронического бронхита, острый синусит), инфекциях кожи и мягких тканей, а также при гинекологических инфекциях.
Внебольничная пневмония
Моксифлоксацин привлекает особое внимание при лечении внебольничной пневмонии в связи с его высокой активностью в отношении фактически всех наиболее вероятных возбудителей, включая полирезистентные пневмококки, гемофилы, продуцирующие b-лактамазы, а также внутриклеточные (атипичные) возбудители М. pneumoniae и С. pneumoniae [9, 25, 27].
Ни один из других классов антибактериальных препаратов не обладает таким широким спектром активности и способностью преодолевать приобретенную резистентность респираторных патогенов, как новые фторхинолоны. Например, к макролидам в последнее время часто отмечается ассоциированнал резистентность: 45% пенициллинорезистентных пневмококков устойчивы к эритромицину [51], в то время как МПК90 моксифлоксацина для таких штаммов составляет 0,5 мг/л [14].
Хорошие микробиологические характеристики сочетаются с благоприятной фармакокинетикой и фармакодинамикой моксифлоксацина: длительный период полувыведения, обеспечивающий однократный прием, высокие концентрации в тканях бронхов и легких, оптимальные значения показателей ПФК/МПК и ПФК/МПКнесвя, [49].
В обзоре приведены данные 3 рандомизированных двойных слепых исследований клинической и бактериологической эффективности моксифлоксацина при внебольничной пневмонии (табл. 11). В 2 исследованиях сравнивали эффективность моксифлоксацина и кларитромицина. По клинической эффективности они были равны — 94-95% [52, 53]. По данным G. Hoffken и соавт., бактериологическая эффективность моксифлоксацина выше 2 , чем кларитромицина — 90 и 85% соответственно [53].
При внебольничной пневмококковой пневмонии клиническая эффективность моксифлоксацина оказалась такой же как у амоксициллина, а у пациентов, у которых был выделен нечувствительный к пенициллину пневмококк, была выше 2 — 89,7 против 82,4%. Частота эрадикации возбудителя составила 89,6 и 84,8%, соответственно [54].
По данным метаанализа 4 многоцентровых исследований, в которых сравнивали эффективность моксифлоксацина и кларитромицина или амоксициллина, при приеме моксифлоксацина излечение наступало в 91% случаев, а эрадикация возбудителя — в 96% случаев по сравнению с эрадикацией в 86% случаев для амоксициллина и в 90% — для кларитромицина [55]. МПК моксифлоксацина для пневмококка составила 0,125 мг/л вне зависимости от чувствительности к пенициллину или кларитромицину.
Таблица 11. Эффективность моксифлоксацина при лечении внебольничной пневмонии
| Авторы [ссылка], дизайн | Препараты сравнения | ||||||
| клиническая | бактерио- логическая | ||||||
| С. Fogarty et al. [52], Р, ДС | Мокси | 194 | 400 мг 1 раз в сутки | 10 | 94,8** | 97,1 | Мокси = Кларитро |
| Кларитро | 188 | 500 мг 2 раза в сутки | 10 | 94,7** | 96,0 | ||
| G. Hoffken et al. [53], Р, ДС | Мокси | 180 | 200 мг 1 раз в сутки | 10 | 93,9 | 90,6 | КЭ: Мокси 200 мг = Мокси 400 мг = Кларитро БЭ: Мокси 200 мг = Мокси 400 мг = Кларитро |
| Мокси | 177 | 400 мг 1 раз в сутки | 10 | 94,4 | 90,2 | ||
| Кларитро | 174 | 500 мг 2 раза в сутки | 10 | 94,3 | 85,3 | ||
| P. Petipretz et al. [54], Р, ДС | Мокси | 177 | 400 мг 1 раз в сутки | 10 | 91,5 | 89,7 | Мокси = Амокс |
| Амокс | 185 | 1 г 3 раза в сутки | 10 | 89,7 | 82,4 |
Мокси — моксифлоксацин, Кларитро — кларитромицин, Амокс — амоксициллин,
КЭ — клиническая эффективность, БЭ — бактериологическая эффективность,
Р — рандомизированное исследование, ДС — двойное слепое исследование.
* После окончания лечения.
** Общая эффективность.
Обострение хронического бронхита
При лечении обострения хронического бронхита, вызванного бактериальными возбудителями, в двух рандомизированных двойных слепых исследованиях сравнивали действие моксифлоксацина и кларитромицина (табл. 12). Ни у одного препарата не выявлено преимуществ по клинической эффективности после окончания лечения [56, 57]. Однако следует отметить, что бактериологическая эффективность моксифлоксацина была статистически значимо выше, чем кларитромицина: 91,3 и 68,4% соответственно (95% ДИ 3 : 8,5 и 27,7%) [57].
При терапии моксифлоксацином эрадикация Н. influenzae наступала чаще (100%), чем при применении кларитромицина (83%), а частота эрадикации остальных микроорганизмов была одинаковой [56].
Аналогичная ситуация наблюдалась и в исследовании R. Wilson и соавт.: эрадикация Н. influenzae наступала через 14 дней после окончания лечения в 90,9% случаев при приеме моксифлоксацина и в 53,5% — при приеме кларитромицина [57].
По результатам рандомизированного открытого исследования, моксифлоксацин превосходил по клинической эффективности амоксициллин/клавуланат (табл. 12) [58]. Частота выздоровления через 7 дней лечения моксифлоксацином была статистически значимо выше, чем при приеме амоксициллина/клавуланата: 96,2 и 91,6% соответственно (95% ДИ 3 : 0,4 и 8,7%).
Таблица 12. Эффективность моксифлоксацина при лечении обострений хронического бронхита
[56], Р, ДС
= Мокси 10 дней
= Кларитро
[57], Р, ДС
[58], Р, О
500 мг 1 раз в сутки
1, 250 мг 1 раз в сутки
в дни 2-5
Мокси — моксифлоксацин, Кларитро — кларитромицин, Амокс/клав — амоксициллин/клавуланат, Азитро — азитромицин, КЭ — клиническая эффективность, БЭ — бактериологическая эффективность, Р — рандомизированное исследование, ДС — двойное слепое исследование, О — открытое исследование.
* После окончания лечения.
** Статистически значимо.
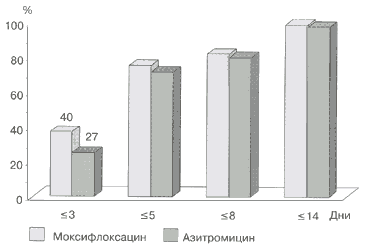
При сравнении действия моксифлоксацина и азитромицина клиническая эффективность обоих препаратов была практически одинаковой — 85 и 81% соответственно. Однако при назначении моксифлоксацина излечение наступало быстрее, чем при лечении азитромицином: к 3-му дню терапии отметили разрешение симптомов 40% пациентов, принимавших моксифлоксацин, и 27% больных (р = 0,012), лечившихся азитромицином (рис. 4).
Рис. 4. Частота разрешения симптомов обострения хронического бронхита при приеме моксифлоксацина и азитромицина [59]
К 3-му дню терапии вернулись к нормальной активности 36% больных, лечившихся моксифлоксацином, и 26% пациентов, принимавших азитромицин [59].
В исследовании С. DeAbate и соавт. клиническая эффективность моксифлоксацина и азитромицина была одинаковой (88%). Однако частота эрадикации Н. influenzae и Н. parainfluenzae при приеме моксифлоксацина (97 и 88%) была выше, чем при назначении азитромицина (83 и 62%) [60].
Как показал метаанализ 4 многоцентровых исследований, в которых сравнивали эффективность лечения обострения хронического бронхита моксифлоксацином и кларитромицином, при приеме моксифлоксацина клиническое излечение наступало в зависимости от превалирующего возбудителя в 92-100% случаев, а эрадикация микроорганизмов в 96-98%. Эрадикация Н. influenzae при приеме моксифлоксацина наступала в 97% случаев против 72% при приеме кларитромицина [61].
В отличие от многих других антибиотиков моксифлоксацин достаточно принимать один раз в сутки более коротким курсом, что позволяет снизить число дней нетрудоспособности и расходы на лечение.
Острый синусит
Клиническая и бактериологическая эффективность моксифлоксацина сравнивалась с эффективностью цефуроксима в двух рандомизированных двойных слепых исследованиях (табл. 13). Моксифлоксацин был или равен цефуроксиму [62], или превосходил его по клинической эффективности: 96,7 и 90,7% соответственно (95% ДИ: 1,5 и 10,6%) [63]. Бактериологическая эффективность, по данным R. Siegert и соавт., также была статистически значимо выше при приеме моксифлоксацина: 94,5 и 83,5% (95% ДИ: 3,6 и 19,7%) [63].
Таблица 13. Эффективность моксифлоксацина при лечении острого синусита
Мокси — моксифлоксацин, Цефур — цефуроксим аксетил, Р — рандомизированное исследование, ДС — двойное слепое исследование.
* После окончания лечения.
** Статистически значимо.
Метаанализ 4 многоцентровых исследований, в которых сравнивали эффективность моксифлоксацина и цефуроксима, показал, что при приеме фторхинолона излечение наступало в 79-95% случаев (в среднем — в 91%), а эрадикация микроорганизмов — в 89-100% (в среднем — в 96%). При приеме цефуроксима излечение наступало в 90% случаев, а эрадикация микроорганизмов — в 93% [64].
Инфекции кожи и мягких тканей
Для лечения неосложненных инфекций кожи и мягких тканей моксифлоксацин применяли по 400 мг 1 раз в сутки в течение 7 дней. По результатам 3 рандомизированных двойных слепых исследований, моксифлоксацин не уступал по клинической и бактериологической эффективности цефалексину и комбинации цефалексина с метронидазолом (табл. 14) [65, 66, 67].
Уменьшение дозы моксифлоксацина до 200 мг существенно не влияло на клиническую эффективность: 95,2% при приеме 200 мг и 100% при приеме 400мг [66].
Таблица 14. Эффективность моксифлоксацина при лечении инфекций кожи и мягких тканей
P. Leal del Rosal et al. [66], Р, ДС
P. Leal del Rosal et al. [67], Р, ДС
Мокси — моксифлоксацин, Цефал — цефалексин, Метро — метронидазол, Р — рандомизированное исследование, ДС — двойное слепое исследование.
Гинекологические инфекции
Воспалительные заболевания органов малого таза вызываются разнообразными микроорганизмами. Среди них преобладают возбудители, передаваемые половым путем (N. gonorrhoeas, С. trachomatis), а также аэробы семейства Enterobacteriaceae, стрептококки и анаэробы, входящие в состав нормальной микрофлоры влагалища — Bacteroides spp., Peptostreptococcus spp., G.vaginalis и др. Поэтому препараты для терапии этих инфекций должны обладать высокой активностью в отношении данных микроорганизмов. Благодаря широкому спектру активности моксифлоксацина, включающему большинство возбудителей гинекологических инфекций, он может быть хорошей альтернативой традиционным 2-3-компонентным схемам лечения.
При терапии неосложненных воспалительных заболеваний органов малого таза у женщин моксифлоксацин (400 мг 1 раз в сутки, 14 дней) был сравним по клинической эффективности (96,6 и 98,0%) с комбинацией ципрофлоксацина (500 мг однократно), доксициклина (100 мг 2 раза в сутки) и метронидазола (500 мг 3 раза в сутки) в течение 14 дней [68].
Бактериологическая эффективность моксифлоксацина была выше 4 , чем в группе сравнения (92,5 и 88,2% соответственно).
Переносимость и нежелательные реакции
По данным метаанализа 26 клинических исследований, включавших 6178 пациентов, которые принимали моксифлоксацин (400 мг), частота нежелательных реакций составила 26% и была сравнимой (23%) с препаратами выбора при лечении этих заболеваний [69].
Наиболее частыми нежелательными реакциями (табл. 15) были тошнота, диарея (14%) и головокружение (3%).
Таблица 15. Частота нежелательных реакций при приеме моксифлоксацина и других препаратов [70]
Моксифлоксацин -400 мг, n=4370
Все препараты сравнения, n=3415
Другие препараты сравнения*, n=580
* Офлоксацин, доксициклии + метронидазол.
| 5 5 исследований — острый синусит, 5 — внебольничная пневмония, 4 — обострение хронического бронхита, 3 -инфекции кожи и мягких тканей, 3 — другие заболевания. Сравнивали эффективность моксифлоксацина и препараты выбора при лечении этих заболеваний. |
В клинических исследованиях частота нежелательных реакций при приеме моксифлоксацина была аналогична частоте при приеме препаратов сравнения — кларитромицина [52, 53, 56, 57] и амоксициллина [54]. Только по данным Т. Burke и соавт., при приеме моксифлоксацина частота приступов тошноты была статистически значимо выше, чем при приеме цефуроксим аксетила (Ни 4% соответственно, р=0,003) [62]. Частота возникновения других нежелательных реакций оказалось аналогичной в группах сравнения.
Изменение лабораторных показателей
Метаанализ 20 клинических исследований показал, что у 1,2% пациентов, принимавших моксифлоксацин, изменялись лабораторные показатели функций печени [70]. Сходные результаты получены в группах сравнения (1,2-1,8%).
Фототоксичность
В исследованиях in vitro [71], на животных [71] и человеке [72, 73] моксифлоксацин не вызывал фототоксических реакций. Это особенно очевидно при сравнении моксифлоксацина с ломефлоксацином, при применении которого значительно (в 3-4 раза) повышается чувствительность кожи к световому излучению [72]. По результатам мета-анализа, у 6178 пациентов, принимавших моксифлоксацин, не отмечено реакций фототоксичности [69].
Влияние на сердечно-сосудистую систему
Как показал метаанализ, из 2650 пациентов, принимавших моксифлоксацин по 400 мг, удлинение интервала QTнаблюдалось у 2,8%, что сходно с препаратами сравнения (2,2%) и ниже, чем при использовании кларитромицина (3,7%) [69]. Из более 1,2 млн человек, принимавших моксифлоксацин, только у 22 отмечены клинически значимые изменения функции сердечно-сосудистой системы, 15 из которых оценены как тяжелые [69].
Описан также случай тахикардии (120 ударов в минуту), продолжавшийся 45 мин после приема 400 мг моксифлоксацина. Повторный прием препарата не вызвал тахикардии [74].
При сравнении действия моксифлоксацина (400 мг) с плацебо у здоровых добровольцев удлинение интервала QT составило 6,9 мс для препарата и 3,5 мс — для плацебо [75]. Одновременный прием моксифлоксацина и препаратов, удлиняющих интервал QT, не приводил к дополнительному его удлинению [76].
Влияние на костно-суставную систему
По данным R. Kubin и С. Reiter, у более 1,2 млн человек, принимавших моксифлоксацин, не выявлено случаев артритов и тендинитов. Однако считается, что необходимо продолжать наблюдения для оценки риска артротоксичности [69].
Влияние на центральную нервную систему (ЦНС)
Наиболее частыми реакциями ЦНС являются головокружение (3%) [69, 70] и головная боль (2%) [70]. Усталость и бессонница встречаются значительно реже.
Влияние на микрофлору носоглотки и кишечника
Моксифлоксацин существенно не влияет на микрофлору носоглотки и кишечника: после окончания приема препарата за короткий период ее состав нормализуется [77, 78].
Лекарственные взаимодействия
Одновременный прием пищи, включая молочные продукты, и кальцийсодержащих препаратов не влияет на всасывание моксифлоксацина [42, 43, 79]. Железосодержащие препараты, антацид «Маалокс» (алюминия гидроксид + магния гидроксид), сукральфат (1 г однократно) при одновременном приеме с моксифлоксацином приводят к уменьшению его всасывания [80, 81, 82]. В связи с этим моксифлоксацин, как и другие фторхинолоны, не следует принимать одновременно с антацидами, препаратами железа и другими лекарственными средствами, содержащими катионы алюминия, магния, цинка, а также с мультиминеральными добавками.
При необходимости приема катионсодержащих препаратов следует соблюдать 2-часовой интервал до приема моксифлоксацина и 4-часовой после приема.
Не выявлено клинически значимого взаимодействия при одновременном приеме моксифлоксацина с пероральными контрацептивами (этилэстрадиол — 0,03 мг и левоноргестрел — 0,15 мг) [83], ранитидином (300 мг/сут [81], дигоксином (0,25 мг/сут) [84], теофиллином (800 мг/сут) [85], варфарином (25 мг/сут в течение 17 дней до приема первой дозы моксифлоксацина) [86].
Дозы и применение
Моксифлоксацин назначается взрослым пациентам (в возрасте 18 лет и старше) по 400 мг 1 раз в сутки. Рекомендуемая длительность его приема при внебольничной пневмонии — 10 дней, при обострении хронического бронхита — 5, при остром синусите — 7, при инфекциях кожи и мягких тканей — 7.
Таблетки следует принимать, не разжевывая и запивая небольшим количеством воды. Одновременный прием пищи не влияет на всасывание препарата. Нет необходимости в коррекции дозы при назначении пациентам с легкой почечной недостаточностью — клиренс креатинина выше 30 мл / (мин * 1,73м 2 ).
Как и все другие фторхинолоны, моксифлоксацин не рекомендуется принимать детям и подросткам, беременным и женщинам, кормящим грудью.
Моксифлоксацин — новый фторхинолон IV поколения, обладающий высокой активностью в отношении грамположительных кокков, включая полирезистентные пневмококки, грамотрицательные бактерии, атипичные возбудители и анаэробы. Благодаря оптимальной фармакокинетике его можно принимать 1 раз в сутки. Препарат хорошо переносится больными, высокоэффективен при лечении инфекций дыхательных путей (острый синусит, обострение хронического бронхита, внебольничная пневмония), инфекций кожи, мягких тканей, органов малого таза. Перспективно применение моксифлоксацина при интраабдоминальных инфекциях.
Отсутствие существенных различий между фармакокинетическими параметрами моксифлоксацина при внутривенном и пероральном введениях в скором будущем позволит применять его в ступенчатой терапии с ранним переходом на прием внутрь.
Фторхинолоны III-IV поколений открыли новый путь терапии инфекций дыхательный путей. Поэтому в современных руководствах по лечению внебольничной пневмонии наряду с b-лактамами и макролидами рекомендуются и новые фторхинолоны, особенно в регионах, где появились полирезистентные пневмококки [87].
При полиэтиологичных инфекциях (в гинекологии, абдоминальной хирургии и др.) применение моксифлоксацина позволит обеспечить более удобную и безопасную монотерапию и, вероятно, сократить затраты на лечение.
Литература
1. Quintiliani R., Owens RJr., Grant E. Clinical role of fluoroquinolones in patients with respiratory tract infections. Infect Dis Clin Pract 1999; 8 (Suppl 1):S28-41.
2. Stass H., Dalhoff A., Kubitza D., Schuhly U. Pharmacokinetics, safety, and tolerability of ascending single doses of moxifloxacin, a new 8-methoxyquinolone, administered to healthy subjects. Antimicrob Agents Chemother 1998; 42:2060-5.
3. Appelbaum P., Hunter P. The fluoroquinolone antibacterials: past, present and future perspectives. Int J Antimicrob Agents 2000; 16:5-15.
4. Ricci V., Piddock L. Characterization of the QRDR of gyrA of Bacteroides fragilis and role in fluoroquinolone resistance. Proceedings of the 38th ICAAC 6 ; 1998 Sep 24-27; San Diego, USA. p. 121.
5. Hooper D. Mechanisms of fluoroquinolone resistance. Drug Resistance Updates 1999; 2:38-55.
6. Janoir C., Zeller V., Kitzis M.D., Moreau N.J., Gutmann L. High-level fluoroquinolone resistance in Streptococcus pneumoniae requires mutations inparCand gyrA. Antimicrob Agents Chemother. 1996; 40: 2760-4.
7. Schmitz F.-J., Fluit A., Scheuring S., et al. Analysis of mechanisms conferring quinolone resistance in Staphylococcus aureus. Clin Microb Infection 1999; 5 (Suppl 3):102.
8. Schedletzky H., Wiedemann В., Heisig P. The effect of moxifloxacin on its target topoisomerases from Escherichia coli and Staphylococcus aureus. J Antimicrob Chemother 1999; 43 (Suppl B):31-7.
9. Jones M., Staple A., Critchley I., et al. Benchmarking the in vitro activities of moxifloxacin and comparator agents against resent respiratory isolates from 377 medical centers throughout the United States. Antimicrob Agents Chemother 2000; 44:2645-52.
10. Blondeau J., Laskowski R., Vaughan D. In vitro activity of BAY 12-8039, a novel fluoroquinolone antimicrobial agent. Proceedings of the 37th ICAAC 6 , 1997. Poster F155.
11. Losa E., Morosini M., Almaraz F., Negri M., Baquero F. Comparative in vitro activity of moxifloxacin against respiratory tract pathogens. Proceedings of the 38th ICAAC 6 ; 1998 Sep 24-27; San Diego, USA. p. 229.
12. Buxbaum A., Straschil U., Moser C., Graninger W., Georgopoulos A. Comparative susceptibility to penicillin and quinolones of 1385 Streptococcus pneumoniae isolates. J Antimicrob Chemother 1999; 43 (Suppl B): 13-8.
13. Sidorenko S., Grudinina S., Kotosova L. Antimicrobial resistance of Streptococcus pneumoniae recovered from respiratory tract infections (RTI) of inpatients in Moscow. Proceedings of the 40th ICAAC 6 ; 2000 Sep 17-20; Toronto, Canada, p. 109.
14. Johnson A., Livermore D., Warner M., James D., George R. Activity of moxifloxacin against invasive and multiresistant pneumococci from England and Wales.
Proceedings of the 39th ICAAC 6 ; 1999 Sep 26-29; San Francisco, USA. p. 255.
15. Milatovic D., Schmitz F., Brisse S., Verhoef J., Fluit A. In vitro activities of sitafloxacin (DU-6859a) and six other fluoroquinolones against 8,796 clinical bacterial isolates. Antimicrob Agents Chemother 2000; 44:1102-7.
16. Souli M., Weneersten C., Eliopoulos G. In vitro activity of BAY 12-8039, a novel 8-methoxyquinolone, against species representative of respiratory tract infections. Proceedings of the 37th ICAAC 6 , 1997. Poster F126.
17. Blondeau J., Church D., Laskowski R., Borsos S. Comparative activity of moxifloxacin and other quinolones against macrolide sensitive and resistant Streptococcus pyogenes. J Antimicrob Chemother 1999; 44 (Suppl A): 131.
18. Jones M., Visser M., Klootwijk M., Heisig P., Verhoef J., Schmitz F. Comparative activities of clinafloxacin, grepafloxacin, levofloxacin, moxifloxacin, ofloxacin, sparfloxacin, and trovafloxacin and nonquinolones linozelid, quinupristin-dalfopristin, gentamicin, and vancomycin against clinical isolates of ciprofloxacin-resistant and -susceptible Staphylococcus aureus strains. Antimicrob Agents Chemother 1999; 43:421-3.
19. Kretchikov V.A., Dekhnich A.V., Pylayeva S.I., Kochetkov G. A., Kozlov R.S. Activity of old and new fluoroquinolones against nosocomial methicillin-resistant Staphylococcus aureus from a trauma hospital. Int J Antimicrob Agents 2001; 17 (Suppl 1): S147.
20. Pass R. In vitro activity of BAY 12-8039, a new 8-methoxyquinolone. Antimicrob Agents Chemother 1997; 41:1818-24.
21. Woodcock J., Andrews J., Boswell F., Brenwald N., Wise R. In vitro activity of BAY 12-8039, a new fluoroquinolone. Antimicrob Agents Chemother 1997; 41:101-6.
22. Кречиков В., Эйделыдтейн И. Активность левофлоксацина и моксифлоксацина в отношении ципрофлоксациннечувствительных нозокомиальных штаммов, продуцентов b-лактамаз расширенного спектра (ESBL). Клин микробиол антимикроб химиотер 2001; 3 (Прил 1): 23.
23. Roblin P., Kutlin A., Reznik Т., Hammerschlag M. Activity of grepafloxacin and other fluoroquinones and newer macrolides against recent clinical isolates of Chlamydia pneumoniae. Int J Antimicrob Agents 1999; 12:181-4.
24. Donati M., Rodriguez Fermepin M., Olmo A., D’Apote L., Cevenini R. Comparative in vitro activity of moxifloxacin, minocycline and azithromycin against Chlamydia spp. J Antimicrob Chemother 1999; 43:825-7.
25. Roblin P., Hammerschlag M. In vitro activity of a new 8-methoxyquinolone, BAY 12-8039, against Chlamydia pneumoniae. Antimicrob Agents Chemother 1998; 42:951-2.
26. Samra Z., Rosenberg S., Soffer Y., Dan M. In vitro susceptibility of recent clinical isolates of Chlamydia trachomatis to macrolides and tetracyclines. Diagn Microbiol Infect Dis 2001; 39:177-9.
27. Duffy L., Kempf M., Crabb D., Wall W., Harrington J. In vitro activity of moxifloxacin and six other new antimicrobials against Mycoplasma pneumoniae. Proceedings of the 39th ICAAC 6 ; 1999 Sep 26-29; San Francisco, USA: p. 252.
28. Bebear C.M., Renaudin H., Boudjadja A., Bebear C. In vitro activity of BAY 12-8039, a new fluoroquinolone against mycoplasmas. Antimicrob Agents Chemother 1998; 42:703-4.
29. Takahata M, Shimakura M., Hori R., et al. In vitro and in vivo efficacies of Т-3811ME (BMS-284756) against Mycoplasma pneumoniae. Antimicrob Agents Chemother 2001; 45:312-5.
30. Ullmann U., Schubert S., Krausse R. Comparative in vitro activity of levofloxacin, other fluoroquinolones, doxycycline and erythromycin against Ureaplasma urealyticum and Mycoplasma hominis.] Antimicrob Chemother 1999; 43 (Suppl C):33-6.
31. Schulin Т., Wennersten C., Ferraro M., Moellering R. Jr., Eliopoulos G. Susceptibilities of Legionella spp. to newer antimicrobials in vitro. Antimicrob Agents Chemother 1998; 42:1520-3.
32. Gomez-Lus R., Adrian F., del Campo R., et al. Comparative in vitro bacteriostatic and bactericidal activity of trovafloxacin, levofloxacin and moxifloxacin against clinical and environmental isolates of Legionella spp. Int J Antimicrob Agents 2001; 18:49-54.
33. Gillespie S., Billington O. Activity of BAY 12-8039 against mycobacteria. Proceedings of the 8th ICID 9 ; 1998 May 15-18; Boston, USA. p. 176.
34. Rivera-Martinez E., Perez-Gonzalez E., Garcia M., Orrantia-Gradm R., Hernandez-Oliva G., Torres-Gutierrez Rubro A. Determination of the in vitro susceptibility of different strains of M. tuberculosis to BAY 12-8039 and other antituberculosis agents. Proceedings of the 8th ICID 7 ; 1998 May 15-18; Boston, USA. p. 173-4.
35. Nord C., Edlund C. Susceptibility of anaerobic bacteria to BAY 12-8039, a new methoxyquinolone. Clin Microb Infection 1997; 3 (Suppl 2):285.
36. MacGowan A., Bowker K., Holt H., Wootton M., Reeves D. BAY 12-8039, a new 8-methoxyquinolone: comparative in vitro activity with nine other antimicrobials against anaerobic bacteria. J Antimicrob Chemother 1997; 40:503-9.
37. Boswell F., Andrews J., Wise R., Dalhoff A. Bactericidal properties of moxifloxacin and post-antibiotic effect. J Antimicrob Chemother 1999; 43 (Suppl B):43-9.
38. Stass H., Kubitza D. Pharmacokinetics and elimination of moxifloxacin after oral and intravenous administration in man. J Antimicrob Chemother 1999; 43 (Suppl B):83-90.
39. Ballow C., Lettieri J., Agarwal V., Liu P., Stass H., Sullivan J. Absolute bioavailability of moxifloxacin. Clin. Ther 1999; 21:513-22.
40. Wise R., Andrews J., Marshall G., Hartman G. Pharmacokinetics and inflammatory-fluid penetration of moxifloxacin following oral or intravenous administration. Antimicrob Agents Chemother 1999; 43:1508-10.
41. Lubasch A., Keller I., Borner K., Koeppe P., Lode H. Comparative pharmacokinetics of ciprofloxacin, gatifloxacin, grepafloxacin, levofloxacin, trovafloxacin and moxifloxacin after single oral administration in healthy volunteers. Antimicrob Agents Chemother 2000; 44:2600-3.
42. Lettieri J., Vargas R., Agarwal V., Liu P. Effect of food on the pharmacokinetics of a single oral dose of moxifloxacin 400 mg in healthy male volunteers. Clin Pharmacokinet 2001; 40 (Suppl l):19-25.
43. Stass H., Kubitza D. Effects of dairy products on the oral bioavailability of moxifloxacin, a novel 8-methoxyfluoro-quinolone, in healthy volunteers. Clin Pharmacokinet 2001; 40 (Suppl l):33-8.
44. Gehanno P., Stass H., Arvis P. Penetration of moxifloxacin (MXF) into sinus tissues following multiple oral dosing. Clin Microb Infection 1999; 5 (Suppl 3):138.
45. Soman A., Honeybourne D., Andrews J., Jevons G., Wise R. Concentrations of moxifloxacin in cerum and pulmonary compartments following a single 400 mg oral dose in patients undergoing fibreoptic bronchoscopy. J Antimicrob Chemother 1999; 44:835-8.
46. Sullivan J., Lettieri J., Liu P., Heller A. The influence of age and gender on the pharmacokinetics of moxifloxacin. Clin Pharmacokinet 2001; 40 (Suppl l):ll-8.
47. Stass H., Halabi A., Delesen H. No dose adjustment needed for patients with renal impairment receiving oral BAY 12-8039 (M). Proceedings of the 38th ICAAC 8 ; 1998 Sep 24-27; San Diego, USA. p. 5.
48. Stass H., Kubitza D. No dose adjustment is needed for moxifloxacin (MOX) in subjects suffering from hepatic impairment (HI). Clin Microb Infection 1999; 5 (Suppl 3):291.
49. Zhanel G., Walters M., KarlowskyJ., LaingN., Hoban D. Activity of free (unbound) fluoroquinolone serum concentrations versus multi-drug resistant Streptococcus pneumoniae using an in vitro pharmacodynamic model. Proceedings of the 40th ICAAC 6 ; 2000 Sept 17-20; Toronto, Canada, p. 7.
50. Wright D., Brown G., Peterson M., Rotschafer J. Application of fluoroquinolones pharmacodynamics. J Antimicrob Chemother 2000; 46:669-83.
51. Murray B. The growing threat of penicillin-resistant Streptococcus pneumoniae. Infect Dis Clin Pract 1997; 6:S21-S27.
52. Fogarty C., Grossman C., Williams J., Haverstock D., Church D. Efficacy and safety of moxifloxacin vs clarithromycin for community-acquired pneumonia. Infect Med 1999; 16:748-63.
53. Hoffken G., Meyer H., Sprenger K., Verhoef L. Efficacy and safety of moxifloxacin (MXF) vs clarithromycin (Clarithro) for the treatment of community-acquired pneumonia (CAP). J Antimicrob Chemother 1999; 44 (Suppl A):127.
54. Petipretz P., Arvis P., Marel M., et al. Oral moxifloxacin versus high-dosage amoxycillin in the treatment of mild-to-moderate, community-acquired, suspected pneumococcal pneumonia in adults. Chest 2001; 119:185-95.
55. Krasemann C., Meyer J., Springsklee M. Moxifloxacin (MXF) in community-acquired pneumonia (CAP) — a bacteriologic and clinical meta-analisis. Clin Microb Infection 1999; 5 (Suppl 3):139.
56. Chodosh S., DeAvate C., Haverstock D., Aneiro L., Church D. Short-course moxifloxacin therapy for treatment of acute bacterial exacerbations of chronic bronchitis. Resp Med 2000; 94:18-27.
57. Wilson R., Kubin R., Ballin L, et al. Five day moxifloxacin therapy compared with 7 day clarithromycin therapy for the treatment of acute exacerbations of chronic bronchitis. J Antimicrob Chemother 1999; 44:501-13.
58. Schaberg T. Comparative effect of moxifloxacin and co-amoxiclav in the treatment of AECB. Clin Microb • Infection 2000: 6 (Suppl 1):135.
59. Kreis S., Herrera N., Golzar N., et al. A comparison of moxifloxacin and azithromycin in the treatment of acute exacerbations of chronic bronchitis. J Clin Outcomes Management 2000; 7: 33-7.
60. DeAbate C., Mathew C., Warner J., Heyd A., Church D. The safety and efficacy of short course (5-day) moxifloxacin vs azithromycin in the treatment of patients with acute exacerbation of chronic bronchitis. Respir Med 2000; 94:-1029-37.
61. Krasemann C., Meyer J., Springsklee M. Moxifloxacin (MXF) in acute exacerbations of chronic bronchitis (AECB) — a bacteriologic and clinical meta-analisis. Clin Microb Infection 1999; 5 (Suppl 3):139.
62. Burke Т., Villanueva C., Mariano H. Jr., et al. Comparison of moxifloxacin and cefuroxime axetil in the treatment of acute maxillary sinusitis. Clin Ther 1999; 21:1664-77.
63. Siegert R., Gehanno P., Nikolaidis P., et al. A comparison of the safety and efficacy of moxifloxacin (BAY 12-8039) and cefuroxime axetil in the treatment of acute bacterial sinusitis in adults. Respir Med 2000; 94:337-44.
64. Krasemann C., Meyer J., Springsklee M. Moxifloxacin (MXF) in acute sinusitis (AS) — a bacteriologic and clinical meta-analisis. Clin Microb Infection 1999; 5 (Suppl 3): 139.
65. Parish L, Heyd A., Haverstock D., Church D. Efficacy and safety of moxifloxacin versus cephalexin in the treatment of mild to moderate acute uncomplicated skin and skin structure infections. J Antimicrob Chemother 1999; 44 (Suppl A):137.
66. Leal del Rosal P., Martinez R., Fabian G., et al. Efficacy and safety of moxifloxacin vs cephalexin in the treatment of mild to moderate uncomplicated skin and soft tissue infections (uSSSI). J Antimicrob Chemother 1999; 44 (Suppl A):148.
67. Leal del Rosal P., Fabian G., Vick-Fragoso R. Efficacy and safety of moxifloxacin vs cephalexin (with or without metronidazole) in the treatment of mild to moderate uncomplicated skin and skin structures infections (uSSSI). Proceedings of the 39th ICAAC 6 ; 1999 Sep 26-29; San Francisco, USA. p. 716.
68. Heystek M., Tellarini M., Schmitz H., Krasemann C. Efficacy and safety of moxifloxacin (Мокси) vs ciprofloxacin plus doxycycline plus metronidazole for the treatment of uncomplicated pelvic inflammatory disease (PID). J Antimicrob Chemother 1999; 44 (Suppl A): 143.
69. Kubin R., Reiter C. Safety update of moxifloxacin: a current review of clinical trials and post-marketing observational studies. Proceedings of the 40th ICAAC 6 ; 2000 Sep 17-20; Toronto, Canada, p. 477.
70. Springsklee M., Reiter C., Meyer J. Safety and Tolerability Profile of Moxifloxacin (MXF). Clin Microb Infection 1999; 5 (Suppl 3):140.
71. Vohr H., Wasinka-Kempka G., Ahr H. Studies on the Phototoxic Potential of a new 8-Methoxyquinolone: BAY 12-8039. Proceedings of the 36th ICAAC 6 ; 1996 Sep 15-18; New Orleans, USA. p. 103.
72. Man I., Murphy J., Fergeson J. Fluoroquinolone photo-toxicity: a comparison of moxifloxacin and lomefloxacin in normal volunteers. J Antimicrob Chemother 1999; 43 (Suppl B):77-82.
73. Ferguson J., Alajmi H., Kubin R., Dagget S., Saggu P. A double-blind, placebo- and lomefloxacin-controlled human volunteer phototest study to determine the pho-tosensitising potential of oral moxifloxacin (BAY 12-8039). Proceedings of the 8th ICID 7 ; 1998 May 15-18; Boston, USA. p.197.
74. Siepmann M., Kirch W. Tachycardia associated with moxifloxacin. BMJ 2001; 322:23.
75. Kubitza D., Delesen H. Influence of oral moxifloxacin on the QTs interval of healthy volunteers. Proceedings of the 40th ICAAC 6 ; 2000 Sep 17-20; Toronto, Canada, p. 475.
76. Hollister A., Haverstock D., Choudhri S. Moxifloxacin has a favorable cardiovascular safety profile in patients taking concominant QTs prolonging drugs. Proceedings of the 40th ICAAC 6 ; 2000 Sep 17-20; Toronto, Canada, p. 476.
77. Beyer G., Hiemer-Bau M., Ziege S., Edlund C., Lode H., Nord C. Impact of moxifloxacin versus clarithromycin on normal oropharyngeal microflora. Eur J Clin Microbiol Infect Dis 2000; 19:548-50.
78. Edlund C., Beyer G., Hiemer-Bau M., Ziege S., Lode H., Nord C. Comparative effects of moxifloxacin and clarithromycin on normal intestinal microflora. Scand J Infect Dis 2000; 32:81-5.
79. Stass H., Ochmann K. No significant interaction between oral moxifloxacin (MOX) and calcium supplements (CAS) in healthy volunteers (HV). J Antimicrob Chemother 1999; 44 (Suppl A):132.
80. Stass H., Kubitza D. Effects of iron supplements on the oral bioavailability of moxifloxacin, a novel 8-methoxy-fluoroquinolone, in humans. Clin Pharmacokinet 2001; 40 (Suppl l):57-62.
81. Stass H., Boettcher M., Ochmann K. Evaluation of the influence of antacids and H2 antagonists on the absorption of moxifloxacin after oral administration of a 400 mg dose to healthy volunteers. Clin Pharmacokinet 2001; 40 (Suppl l):39-48.
82. Stass H., Schuhly U., Wandel C., et al. Study to evaluate the interaction between oral moxifloxacin and sucralfate in healthy volunteers. Proceedings of the 39th ICAAC 6 . 1999 Sep 26-29. San Francisco. USA. p. 2.
83. Sachse R., Stass H., Delesen H., et al. Lack of interaction between moxifloxacin and combined oral contraceptive steroids. Clin Microb Infection 1999; 5 (Suppl 3):141.
84. Stass H., Frey R., Kubitza D., Moller J.-G., Zuhlsdorf M. Influence of orally administered moxifloxacin (MOX) on the steady pharmacokinetics (PK) of digoxin (D) in healthy mail volunteers. J Antimicrob Chemother 1999; 44 (Suppl A):134.
85. Stass H., Kubitza D. Lack of pharmacokinetic interaction between moxifloxacin, a novel 8-methoxyfluoro-quinolone, and theophylline. Clin Pharmacokinet 2001; 40 (Suppl 1):63-70.
86. Muller F., Hundt H., Muir A., et al. Study of the influence of once-daily 400 mg BAY 12-8039 (M) given once daily to healthy volunteers on PK and PD of warfarin (W). Proceedings of the 38th ICAAC 6 ; 1998 Sep 24-27; San Diego, USA. p. 4.
87. Синопальников А., Страчунский Л. Новые рекомендации по ведению взрослых пациентов с внебольнич-ной пневмонией. Клин микробиол антимикроб химиотер 2001; 3(1): 54-68.
Авелокс ® (моксифлоксацин) — Досье препарата
источник