Лекция 7 Нитрофенилалкиламины. Анализ производных нитрофенилалкиламинов, гидроксифенилалифатичеких аминокислот и арилгидроксипропаноламинов
| Название | Анализ производных нитрофенилалкиламинов, гидроксифенилалифатичеких аминокислот и арилгидроксипропаноламинов |
| Анкор | Лекция 7 Нитрофенилалкиламины.doc |
| Дата | 14.04.2017 |
| Размер | 0.86 Mb. |
| Формат файла | |
| Имя файла | Лекция 7 Нитрофенилалкиламины.doc |
| Тип | Анализ #1029 |
| Анализ производных нитрофенилалкиламинов, гидроксифенилалифатичеких аминокислот и арилгидроксипропаноламинов Группу составляют левомицетин и его эфиры – левомицетина стеарат и левомицетина сукцинат. История создания: Левомицетин (хлорамфеникол) относится к группе антибиотиков широкого спектра действия. Он действует против Гр(+) и Гр(-) бактерий, а также против риккетсий. Впервые выделен в 1947 году из культуральной жидкости актиномицета Streptomyces venezuelae и уже через 2 года синтезирован в США. В нашей стране группой ученых под руководством академика М.М. Шемякина получен вначале рацемат (синтомицин), затем левовращающий изомер – левомицетин, полностью идентичный американскому препарату хлорамфеникол. По химической структуре он относится к производным п-замещенного нитробензола. Анализ химической структуры: (ошибки в циф.обозначениях)
Функциональные группы 1. ковалентно связанный хлор 3. Вторичный спиртовой гидроксил 4. Первичный спиртовой гидроксил 5. Ароматическая нитро-группа Левомицетин имеет рядом два ассиметрических атома углерода, следовательно, возможно существование четырех оптически деятельных изомеров и двух рацематов. Или в виде двух пар пространственных антиподов: D(-),L(+)-эритро-изомеры (со строением цис-) и Они отличаются между собой пространственным расположением гидроксила и водорода у первого углерода боковой цепи (трео- по разные стороны, эритро- по одной стороне углеродной цепи): По характеру конфиryрации асимметрического атома углерода в положении С1 оптически активные соединения относят к Д- и L-ряду. Оптическая активность зависит от конфиrypации всех асимметрических атомов углерода, поэтому как в Д-ряду, так и в L-ряду могут быть и левовращающие (-) и правовращающие (+) изомеры. Знак вращения (+) или (-) указывается в скобках после обозначения конфиryрации. Эритро-изомеры очень токсичны и не применяются в медицине. Природный левомицетин, применяющийся в медицине, — это D(-)-трео-изомер. L(+) трео-изомер физиологически не активен, поэтому трео-рацемат обладает 50% активности левомицетина и называется синтомицином. Хлорамфеникол Chloramphenicol (МНН) Левомицетин Leavomycetinum (ЛН) Описание: белый или белый со слабым желтовато-зеленым оттенком кристаллический порошок без запаха горького вкуса. Растворимость: мало растворим в воде, легко растворим в спирте, растворим в этилацетате, нерастворим в хлороформе. 1. Поглощают свет в УФ-области спектра как ароматические соединения и за счёт группировок с двойными (кратными) связями (карбонильная и нитрогруппа). 2. Являются оптически активными веществами. У хлорамфеникола направление оптического вращения зависит от вида растворителя: 5% раствор хлорамфеникола в этаноле вращает плоскость поляризации вправо (+); 5% раствор в этилацетате — влево (-) ФС. 1. ароматическая нитрогруппа; 4. ковалентно связанный хлор; 1. ИК-спектр (по МФ III): сравнивают со спектром сравнения или со спектром, полученным со стандартным образцом ЛВ. 2. ФС УФ-спектр поглощения. 0,002% раствор (растворитель — вода) в области 220-400 нм имеет максимум поглощения λmах=278 нм и минимум поглощения λmin=237 нм. 3. ФС Удельный показатель поглощения (E1см1% ) Е 1% 1см от 290 до 305 при длине волны 278 нм (0,002% водный раствор). 4. ФС Удельное вращение [α]D20 от +18° до +21° (5% раствор в 95% спирте). 6. ФС 5% раствор хлорамфеникола в этаноле вращает плоскость поляризации вправо (+); 5% раствор в этилацетате — влево (-). П.п. 3 –5 физические константанты подлинности и чистоты Реакции подлинности
Реакция основана на образовании аци-соли, гидролитическом расщеплении и восстановительной минерализации. Реакция идёт в несколько стадий. При нагревании препарата со щелочью образуется желтое окрашивание, при дальнейшем нагревании, переходит в красно-оранжевый цвет(аци-соль). При кипячении окрашивание усиливается до кирпично-красного (азо-соединение) и выделяется аммиак. Его определяют по запаху или посинению красной лакмусовой бумаги. После отделения осадка в фильтрате, подкисленном азотной кислотой, определяют хлорид-ион реакцией осаждения с раствором серебра нитрата. Образовавшееся азосоединение можно объяснить диспропорционированием левомицетина. При этом спиртовые гидроксилы окисляются, а нитрогруппа восстанавливается.
Эта реакция является общей, для хлорамфеникола и его эфиров
после восстановления нитрогруппы цинковой пылью в кислой среде при нагревании (Zn в H2SO4 или НСI конц.) до первичной ароматической аминогруппы. Одновременно с восстановлением идет легкая минерализация (дегалогенирование – отщепляются атомы хлора). После диазотирования нитритом натрия в среде НСI разв соль диазония сочетают:
Возможна капельная реакция образования азокрасителя после частичного восстановления нитрогруппы до нитрозогруппы цинковой пылью в среде кальция хлорида при нагревании. В качестве азосоставляющей используют α-нафтиламин в уксуснокислой среде (фиолетовое окрашивание). Фиолетовое окрашивание
За счет слабо-кислых свойств спиртового гидроксила в сочетании с аминогруппой. Левомицетин образует окрашенный растворимый комплекс с солями тяжелых металлов аналогично эфедрину. Образующееся комплексное соединение извлекается в слой н-бутанола, окрашивая его в сине-фиолетовый цвет. + CuSO4 + 4NaOH 2.Общие примеси в пределах эталона хлорид-ионы, сульфатная зола и тяжелые металлы. 1. Посторонние примеси (исходные и промежуточные продукты) методом ТСХ на пластинках «Силуфол». Пластинки просматривают в УФ-свете, должно быть не более трёх посторонних пятен, по интенсивности и величине не превышающих пятна свидетелей. Количественное определение
Метод основан на диазотировании первичной ароматической аминогруппы, полученной после восстановления ароматической нитрогруппы. fэкв.(хлорамф) = 1
Индикатор: крахмал. Добавляют в конце титрования и титруют до исчезновения синего окрашивания. титрант готовят с учетом УЧ 1/ 6 КВrO3,
Для количественного определения хлорамфеникола в субстанциирасчет по РСО, для таблеток левомицетина – расчет по удельному показателю поглощения. Формулы расчета концентрации Сх при использовании РСО (раствора стандартного образца) Из закона бугера-Ламберта следует величина оптической плотности прямо пропорциональна величине концентрации раствора и толщине слоя. где Dх — оптическая плотность испытуемого раствора; D— оптическая плотность раствора стандартного образца; Сх — концентрация испытуемого раствор; C — концентрация раствора стандартного образца. 1 2 3 1 часть – основа из закона Бугера– Ламберта – Бера где а – навеска сухого вещества в граммах, порошка таблеток или объем раствора, взятый для анализа Vк1, Vк2 – объем разведения (1колбы и 2 колбы) Vпр –объем пробы (пипетки) взятой из 1разведения (Vк1 ) для приготовления 2 разведения (Vк2 ) 3 часть –пересчет на лекарственную форму 1 2 3 Согласно закону Бугера-Ламберта-Бера величина D прямо пропорциональна величине концентрации раствора и толщине слоя. Е 1% 1см(константа) Удельный показатель поглощения – это оптическая плотность раствора, содержащего 1,0 вещества в 100 мл (1%) раствора при толщине слоя 1 см.
Титрант раствор меди (II) сульфата (0,01 моль/л), индикатор мурексид. Проводят контрольный опыт, чтобы точнее определить переход окраски в точке эквивалентности.
Индикатор: крахмал. Добавляют в конце титрования и титруют до исчезновения синего окрашивания.
Минерализацию проводяткипячением с растворами натрия гидроксида и водорода пероксида. R – CHCl22NaCl
С% = α∙100 / l∙[α]Хранение: список Б, ХУТ из оранжевого стекла. Левомицетин относительно устойчив. Однако в водных растворах, под действием неблагоприятных факторов: солнечного света, температуры, солей тяжелых металлов, могут происходить реакции окисления, восстановления, конденсации, при этом образуются: Применение: антибиотик широкого спектра действия. Хлорамфеникола стеарат – Левомицетина стеарат Chloramphenicol Stearate (МНН) Leavomycetini Stearas (ЛН) Описание: белый или белый с желтоватым оттенком кристаллический порошок практически без запаха и вкуса. Растворимость: практически нерастворим в воде, трудно растворим в спирте, легко растворим в хлороформе и ацетоне с образованием мутных растворов. 1.Удельное вращение [α]D20 = от +15˚ до +20˚ (5% раствор в 95% спирте). Растворение проводят при нагревании до 40˚, в случае необходимости фильтруют. 2. Температура плавления. 88—90˚С. Помимо всех реакций, характерных для левомицетина, дает реакцию на стеариновую кислоту – реакция отличия левомицетина стеарата от левомицетина
Чистота
Количественное определение
— для субстанции – расчет по раствору стандартного образца Содержание левомицетина в препарате должно быть не менее 51,0% и не более 55,0%. 2. Обратная алкалиметрия – омыление щелочью и титрование избытка гидроксида натрия соляной кислотой. 3. Все методы, применимые для левомицетина. Применение: антибиотик широкого спектра действия. Этот эффект обусловлен активным левомицетином, который освобождается из сложного эфира при ферментативном гидролизе в ЖКТ после перорального приема. Основное его достоинство – отсутствие горького вкуса, что расширяет возможности его применения в педиатрии. Формы выпуска: порошок, таб 0,25, гранулы, суспензия. Левомицетина сукцинат растворимый Хлорамфеникола натрия сукцинат (растворимый) Chloramphenicol sodium succinate (МНН) Laevomycetini succinas solubile (ЛН) Описание: сухая пористая масса белая или с желтоватым оттенком, со слабым специфическим запахом, горького вкуса, гигроскопичен. Растворимость: легко растворим в воде, мало растворим в спирте. 2. УФ-спектр поглощения. 0,04% раствор (растворитель — вода) в области 230-350 нм имеет максимум поглощения λmах=276 нм. 4. Удельное вращение после кипячения с обратным холодильником в НСI 20% + метиловый спирт[α]D20 = от -11 0 до -12,6 0 . Реакции подлинности
янтарная кислота Гидроксамовая реакция вписать реакцию самостоятельно!
Количественное определение
Хранение: список Б, сухое, защищенное от света место, температура хранение не больше 20°С. Выпускается во флаконах по 1,0 и 0,5 в расчете на левомицетин. Применение: антибиотик для инъекций. Рис. 16. УФ- спектр левомицетина: раствор РСО левомицетина; таблетки левомицетина 0,5г ПРОИЗВОДНЫЕ ОКСИФЕНИЛАЛИФАТИЧЕСКИХ АМИНОКИСЛОТ По химическому строению эта группа лекарственных веществ являются аналогами природной аминокислоты L-тирозина: Особого внимания в данной группе ЛС заслуживают леводопа и метилдопа. Они имеют сходную химическую и, соответственно, методы качественного и количественного анализа. Леводопу применяют для лечения паркинсонизма, заболевания центральной нервной системы, вызванного снижением содержания допамина в базальных ганглиях мозга. Леводопа или Дофа (см. тему«Арилалкиламины, гидроксифенилалкиламины») — это биогенное вещество, которое в организме образуется из тирозина и является предшественником допамина (дофамина). Леводопа (ДОФА) легко проникает через гематоэнцефалический барьер, накапливается в головном мозге и при декарбоксилировании превращается в допамин. Сам допамин для лечения паркинсонизма не используется, т.к. плохо проникает через гематоэнцефалический барьер. Формы выпуска. | ||
| Леводопа 3-Гидрокси – L-тирозин [или (-) – 3 (3,4 –Дигидроксифенил) – L — аланин] | Levodopa (МНН) таблетки и капсулы 0,25 г и 0,5 г α 3-Гидрокси α-метил – L-тирозин [или (-) – 3 -(3,4 –Дигидроксифенил) – 2 — метилаланин] | Methyldopa (МНН) 1,5Н2О |
Леводопа: L-3-(3’,4’-диоксифенил)-2-аминопропионовая кислота
Метилдопа: L-3-(3’,4’-диоксифенил)-2-митиламинопропионовая кислота сесквигидрат
леводопа – белый или почти белый кристаллический порошок без запаха, мало растворим в воде, не растворим в этаноле, хлороформе и эфире. Плохая растворимость в воде – следствие существования в виде прочных внутренних солей.
метилдофа – белый или желтовато-белый кристаллический порошок или кусочки без запаха, растворим в воде и спирте, трудно в эфире, очень легко растворим в соляной кислоте.
Изомерия оба препарата левовращающие изомеры.
Обусловлены наличием функциональных групп:
2. Первичная алифатическая аминогруппа.
3. Карбоксильная группа.
Лекарственные вещества проявляют свойства фенолов и
алифатических α-аминокислот.
Как аминокислоты проявляют амфотерные свойства:
- слабые кислотные свойства за счет карбоксильной группы и двух фенольных гилроксилов, растворяются в щелочах, образуя тринатриевые соли:
И в гидрокарбонатах щелочных металлов, образуя мононатриевую соль только по карбоксильной группе.
- основные свойства обусловлены первичной алифатической амино-группой, растворяются в кислотах:
Подлинность (согласно ФС МФ III)
1. ИК-спектр. Сравнивают со спектром сравнения или со спектром, полученным со стандартным образцом ЛВ.
Особенность – при возможности проведения СФМ в ИК-области, химические реакции не проводят
[αD 20 ]= от -160 0 до -167 0 (леводопа) , [αD 20 ] = от -25 0 до -28 0 (метилдопа)ЛВ можно отличить друг от друга по физическим константам.
Реакции подлинности (общие)
- Реакции на пирокатехиновый фрагмент
- ФСРеакция комплексообразования с железа (III) хлоридом (на фенольные гидроксилы пирокатехинового фрагмента), появляется зелёное окрашивание. При добавлении гексаметилентетрамина (метенамина) зелёное окрашивание переходит в сине-фиолетовое.
- реакции окисления пирокатехинового ядра до о-хинона:
Аминокислотный остаток тоже окисляется по общим правилам окисления аминокислот.
Например. В случае мягкого окисления аминокислоты с нитритом натрия в кислой среде образуют желто-оранжевое окрашивание. Если затем добавить гидроксид натрия, то образуется темно-красное:
2. Реакции на аминокислотный фрагмент
3) ФС Реакция с нингидрином «нингидриновая проба» — для всех аминокислот (см. «Алифатические аминокислоты»). При нагревании появляется сине-фиолетовое окрашивание.
4) Реакция комплексообразования с солями меди (II) в щелочной среде – аналогично алифатическим аминокислотам:
- ФС МФ III Реакция отличия леводопы и метилдопы – реакция с 4-нитробензоил-хлоридомв среде пиридина.
Леводопа: фиолетовое окрашивание, которое при кипячении переходит в бледно-желтое, а при добавлении карбоната натрия опять в фиолетовое.
Метилдопа: оранжевое или янтарное окрашивание.
Чистота
- Определяют в пределах эталона общие примеси (сульфатная зола, тяжёлые металлы).
- кислотность (по метиловому красному)
- вода (титрование реактивом Фишера)
- примесь 3-о-метилпроизводных методом ТСХ
Количественное определение:
1.ФС – кислотно-основное титрование (ацидиметрия) в среде неводного (протогенного) растворителя.
Протогенные растворители:
для леводопы — лед. уксусная кислота СН3СООН+НСООН безводн.;
для метилдопы — лед. уксусная кислота СН3СООН+диоксан.
Индикатор — кристаллический фиолетовый.
ClO4 —
- ФССФМ-метод в УФ-области за счет наличия максимумов поглощения в УФ-спектре. Метод используют в анализе лекарственных препаратов заводского производства (для таблеток, капсул).
- Формольное титрование по Сёренсону (алкалиметрия после взаимодействия с формальдегидом). Для блокирования аминогруппы предварительно добавляют формальдегид, образуется устойчивое метиленовое производное, усиливаются кислотные свойства аминокислоты. Индикатор – нейтральный красный
4.Поляриметрия за счет наличия ассиметрического атома углерода.
5. ФЭК по цветным реакциям
6. Метод Кьельдаля
Хранение: по списку Б в хорошо укупоренной таре, предохраняющей от действия света, а леводопу – в прохладном, темном месте, вдали от прямого света (т.к. легко окисляются).
Леводопа— антипаркинсоническое средство, назначают при болезни Паркинсона и паркинсонизме.
Метилдопа — гипотензивное средство, для лечения гипертонии.
Леводопа при введении в организм проникает через ГЭБ, декарбоксилируется и превращается в дофамин, восполняя его недостаток в ЦНС, который наблюдается при болезни Паркинсона. Таким образом, леводопа – это предшественник БАВ дофамина. Сам дофамин через ГЭБ не проникает и для этой цели не применяется.
Метилдофа – гипотензивное средство при введении в организм проникает через ГЭБ в ЦНС и превращается сначала в α-метилдофамин, а затем в α-метилнорадреналин, который, стимулируя центральные α2-адренорецепторы, уменьшает поток симпатических импульсов из ЦНС и снижает высвобождение норадреналина из нервных окончаний, что приводит к снижению АД.
ЛВ группы относятся к β-адреноблокаторам (пропранолола гидрохлорид, атенолол, тимолола мелеат). Они содержат гидроксиаминопропанольную группу.
Пропранолола гидрохлорид Propranolol Hydrochloride (МНН)
Белый кристаллический порошок без запаха, горького вкуса.
Растворим в воде и спирте, не растворим в эфире и бензоле. Растворение в воде сопровождается появлением опалесценции или мути, исчезающих при подкислении раствора 2-3 каплями минеральной кислоты.
Подлинность
- УФ-спектр поглощения. Раствор имеет максимумы поглощения при длине волны 290 нм (λmах=290 нм), 306 и 319.
- ИК-спектр в области 2000-400 см-1. Полосы поглощения должны полностью совпадать по длинне волны и интенсивности с прилагаемым к НД (ФС) рисунком спектра.
- Т°пл
- ФС Реакция на кислотно-основные свойства
ЛВ — соль, поэтому можно вытеснить слабое органическое основаниев виде белого осадка сильным основанием гидроксидом натрия.
Основание извлекают эфиром и отгоняют эфир на водяной бане.
Определяют Т°пл основания анаприлина(пропронолола) (92°-97°).
Чистота
- рН 5,0-6,0 потенциометрически.
- Прозрачность и цветность раствора, так как возможны процессы гидролиза солей с выделением оснований (помутнение) и окисление по вторичному спиртовому гидроксилу (изменение окраски).
1.ФС КОТ в среде протогенного растворителя: ледяной уксусной кислоты и диацетата ртути. Индикатор – кристаллический фиолетовый (до голубого) или потенциометрически со стеклянным индик. электродом.
2. ФС СФМ в УФ-области–раствор для инъекций.
3. Алкалиметрия по связанной хлороводородной кислоте.
4. Аргентометрия по хлорид-иону (см. новокаин, эфедрин, изадрин)
Хранение: список Б, ХУТ, в защищенном от света месте, при комнатной температуре.
Применение: бета 1– адреноблокатор длительного действия. Антиангинальное, гипотензивное и антиаримтмическое при гипертонической болезни и аритмии.
источник
Латинские, русские и химические названия, а также строение и физические свойства ЛС, производных нитрофениалкиламинов представлены в таблице 1 [4,14,15,17,20].
Таблица 1 Строение и физические свойства лекарственных средств, производных нитрофениалкиламинов
Chloramphenicol — хлорамфеникол (Левомицетин)
Белый или белый со слабым желтовато-зеленым оттенком кристаллический порошок без запаха. Температура плавления 149-1530 С. Удельное вращение от +18 до +210 (5%-ный раствор в этаноле).
Мало растворим в воде, легко растворим в спирте, растворим в этилацетате, нерастворим в хлороформе.
Chloramphenicol Stearate — хлорамфеникола стеарат
Белый с желтоватым оттенком порошок, практически без запаха и вкуса. Температура плавления 88-900 С. Удельное вращение от +15 до +200 (5%-ный раствор в этаноле).
Практически нерастворим в воде, трудно растворим в спирте, легко растворим в хлороформе и ацетоне с образованием мутных растворов.
Chloramphenicol Sodium Succinate — хлорамфеникола натрия сукцинат
D-(-)-трео-1-n-нитрофенил-2-дихлорацетиламинопропандиол-1,3 3-сукцинат натрия
Порошок белого или с желтоватым оттенком цвета, со слабым специфическим запахом. Гигроскопичен. Удельное вращение от +5 до +80 (5%-ный раствор в этаноле).
Легко растворим в воде, мало растворим в спирте.
1. Общей реакцией для левомицетина и его эфиров является реакция гидролитического расщепление в щелочной среде при нагревании (щелочное разложение). Реакция основана на образовании аци-соли по ароматической нитро-группе, гидролитическом расщеплении и восстановительной минерализации [1,2,4,10,15,17].
Реакция идёт в несколько стадий. При нагревании препарата со щелочью образуется желтое окрашивание, при дальнейшем нагревании, переходит в красно-оранжевый цвет (аци-соль). При кипячении окрашивание усиливается до кирпично-красного (азо-соединение) и выделяется аммиак. Его определяют по запаху или посинению красной лакмусовой бумаги. После отделения осадка в фильтрате, подкисленном азотной кислотой, определяют хлорид-ион реакцией осаждения с раствором серебра нитрата.
Образовавшееся азо-соединение можно объяснить диспропорционированием молекулы левомицетина. При этом спиртовые гидроксилы окисляются, а нитрогруппа восстанавливается.
Эта реакция специфична и доказывает многие характерные особенности структуры левомицетина:
— нитрофенильный радикал — по образованию азобензойной кислоты;
— ковалентно-связанный хлор — по образованию натрия хлорида и обнаружению хлорид-иона реакцией с нитратом серебра;
— наличие амидной группы — по образованию аммиака.
2. Реакция образования азокрасителя после восстановления нитрогруппы цинковой пылью в кислой среде при нагревании (Zn в H2SO4 или НСL конц.) до первичной ароматической аминогруппы. Одновременно с восстановлением идет легкая минерализация (дегалогенирование — отщепляются атомы хлора) [1,2,4,10,15].
После диазотирования нитритом натрия в среде НСLразв. соль диазония сочетают:
1) по ФС в щелочной среде с в-нафтолом, образуется азокраситель (красное окрашивание) [17,18,19];
2) в кислой среде с N-фенил-в-нафтиламином оранжево-красное окрашивание
Возможна капельная реакция образования азокрасителя после частичного восстановления нитрогруппы до нитрозогруппы цинковой пылью в среде кальция хлорида при нагревании. В качестве азосоставляющей используют б-нафтиламин в уксуснокислой среде (фиолетовое окрашивание).
3. Реакция образования основания Шиффа. После последовательного гидрирования (Zn в H2SO4 или НСL конц.) первичную ароматическую аминогруппу определяют с п-диметиламинобензальдегидом конденсацией. Образуется основание Шиффа ярко-оранжевого цвета [1,2,15].
4. Реакция с меди (II) сульфатом в щелочной среде гидроксида натрия.
Обусловлена слабыми кислотными свойствами спиртового гидроксила в сочетании с аминогруппой. Левомицетин образует окрашенный растворимый комплекс с солями тяжелых металлов аналогично эфедрину [1,2,15].
Образующееся комплексное соединение извлекается в слой н-бутанола, окрашивая его в сине-фиолетовый цвет.
Возможен вариант комплексообразования за счёт двух спиртовых гидроксилов:
ИК-спектр: сравнивают со спектром сравнения или со спектром, полученным со стандартным образцом лекарственного вещества (см. рис.2) [9,14,15,17,20].
6. Высокоэффективная жидкостная хроматография. Показатель времени удерживания основного пика на хроматограмме раствора исследуемого вещества должен соответствовать времени удерживанию пика раствора стандартного образца [14,17,20].
7. УФ-спектр поглощения. 0,002% раствор (растворитель — вода) в области 220-400 нм имеет максимум поглощения лmах=278 нм и минимум поглощения лmin=237 нм (см. рис.3) [9,14,15,17,20].
Имеется множество вариантов оптических методов определения левомицетина в лекарственных формах [3,9,10,14,15].
Согласно литературным данным, левомицетин поглощает в ультрафиолетовой области от 205 до 400 нм.
Максимум светопоглощения находится при 278 — 280 нм.
Значительное место занимают колориметрические методы, основанные на различных специфических цветных реакциях. Чувствительность этих методов невысока и составляет 0,1 мг/см3 и более [3,9].
1. Реакция на стеариновую кислоту — кислотный гидролиз сложно-эфирной группы с образованием стеариновой кислоты и левомицетина. На поверхности всплывают маслянистые капли стеариновой кислоты, застывающие при охлаждении [1,2,4,10,15].
1. Реакция на остаток янтарной кислоты: с резорцином и концентрированной серной кислотой при нагревании кристаллов ЛВ появляется кирпично-красное окрашивание, при охлаждении, добавлении воды и гидроксида натрия до щелочной реакции образуется оранжевый раствор с зеленой флюоресценцией в УФ-свете [1,2,4,10,15]:
3. Реакции на катион-натрия [1,2,4,10,15]:
а) при внесении препарата в бесцветное пламя горелки — пламя окрашивается в желтый цвет;
б) реакция с цинкуранилацетатом с образованием желтых кристаллов, характерной формы:
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9Н20 >
источник
Куприметрический метод. Метод основан на свойстве хлорамфеникола образовывать с меди (II)сульфатом в щелочной среде устойчивые комплексные соединения.
Титрант раствор меди (II) сульфата (0,01 моль/л), индикатор мурексид. Проводят контрольный опыт, чтобы точнее определить переход окраски в точке эквивалентности.
Сначала идет образование растворимого в воде комплекса с избытком сульфата меди в щелочной среде. Образовавшийся комплекс отфильтровываем, на фильтре остается избыток сульфата меди в виде осадка гидроксида меди (щелочная среда).
Затем фильтрат обрабатывают серной кислотой, комплекс разрушается
Образовавшийся сульфат меди определяют йодометрически.
Сульфат меди выделяется в эквивалентном количестве, вступившем в реакцию с левомицетином. На 2 моль левомицетина – 1 моль сульфата меди
Индикатор: крахмал. Добавляют в конце титрования и титруют до исчезновения синего окрашивания.
Аргентометрический (вариант Фаянса) или меркуриметрический метод (после восстановительной минерализации ковалентно связанного хлора до хлорид-иона).
Минерализацию проводят кипячением с растворами натрия гидроксида и водорода пероксида.
R 
Образовавшийся натрия хлорид титруют раствором серебра нитрата, либо раствором ртути (II) нитрата.
ФЭК по цветным реакциям, например по образованию азокрасителя.
Поляриметрия расчет по удельному вращению
Хранение: список Б, ХУТ из оранжевого стекла. Левомицетин относительно устойчив. Однако в водных растворах, под действием неблагоприятных факторов: солнечного света, температуры, солей тяжелых металлов, могут происходить реакции окисления, восстановления, конденсации, при этом образуются:
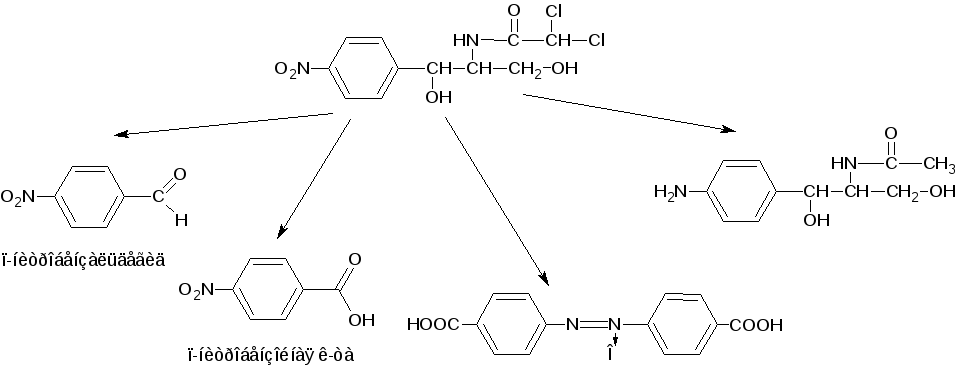
Chloramphenicol Stearate (МНН) Leavomycetini Stearas (ЛН)
Описание: белый или белый с желтоватым оттенком кристаллический порошок практически без запаха и вкуса.
Растворимость: практически нерастворим в воде, трудно растворим в спирте, легко растворим в хлороформе и ацетоне с образованием мутных растворов.
1.Удельное вращение [α]D20 = от +15˚ до +20˚ (5% раствор в 95% спирте). Растворение проводят при нагревании до 40˚, в случае необходимости фильтруют.
2. Температура плавления. 88—90˚С.
Помимо всех реакций, характерных для левомицетина, дает реакцию на стеариновую кислоту – реакция отличия левомицетина стеарата от левомицетина
ФС Реакция на стеариновую кислоту – кислотный гидролиз сложноэфирной группы с образованием стеариновой кислоты и левомицетина. На поверхности всплывают маслянистые капли стеариновой кислоты, застывающие при охлаждении.

Гидроксамовая проба на сложно-эфирную группу.
хлориды, сульфаты, тяжелые металлы, мышьяк – в пределах эталона
В хлорамфеникола стеарате определяют свободную стеариновую кислоту (не более 3%) алкалиметрическим методом нейтрализации в спиртовой среде, индикатор — фенолфталеин:
— для субстанции – расчет по раствору стандартного образца Содержание левомицетина в препарате должно быть не менее 51,0% и не более 55,0%.
— для таблеток – расчет по удельному показателю поглощения
2. Обратная алкалиметрия – омыление щелочью и титрование избытка гидроксида натрия соляной кислотой.
3. Все методы, применимые для левомицетина.
Применение: антибиотик широкого спектра действия. Этот эффект обусловлен активным левомицетином, который освобождается из сложного эфира при ферментативном гидролизе в ЖКТ после перорального приема. Основное его достоинство – отсутствие горького вкуса, что расширяет возможности его применения в педиатрии.
Формы выпуска: порошок, таб 0,25, гранулы, суспензия.
Левомицетина сукцинат растворимый
Хлорамфеникола натрия сукцинат (растворимый)
Chloramphenicol sodium succinate (МНН)
Laevomycetini succinas solubile (ЛН)
Описание: сухая пористая масса белая или с желтоватым оттенком, со слабым специфическим запахом, горького вкуса, гигроскопичен.
Растворимость: легко растворим в воде, мало растворим в спирте.
источник
А. Эфедрин  | Б. L -тироксин  |
В Левомицетин  | Г. Анаприлин  |
37. Амидная группа характерна для строения:
А.  | Б.  | В.  |
Г.  | Д.  |
38. Одно из лекарственных веществ не дает азокрасителя:
В. Адреналина гидрохлорида
39. Образование арилметанового красителя характерно для:
А.  | Б.  |
В.  | Г.  |
Одно из лекарственных веществ не выпускается в виде соли.
41. Метод неводного титрования в среде протогенного растворителя применим для:
Д. Для всех вышеперечисленных
42. Гидроксамовая проба по двум функциональным группам возможна для:
А.  |
Б.  |
В.  |
43. В реакцию комплексообразования с солями меди вступают:
Д. Все вышеперечисленные лекарственные средства
44. Общими реакциями для лекарственных веществ, производных оксифенилалкиламинов и оксифенилалифатических аминокислот являются образование:
В. Арилметанового красителя
Г. Окрашенного комплекса с железа (III) хлоридом
Д. Все вышеперечисленные реакции
45. Левомицетин в определённых условиях даёт все реакции кроме одной:
А. Образование азокрасителя
Г. Образование арилметанового краителя
46. Одно из лекарственных веществ относится к синтетическим адреномиметикам:
Б. Норадреналина гидротартрат
47. Примесь адренолона в адреналине гидротартрате определяют методом:
48. Синтомицин — смесь D-(-)-трео- и L- (+)-трео — изомеров левомицетина — применяется как лекарственное средство:
А. Для наружного применения в виде мазей
Б. В виде инъекционных растворов
49. Левомицетин (хлорамфеникол) — антибиотик, выделенный из актиномицетов это первое из нитросоединений, найденных в природе и первый из антибиотиков, полученных:
Б. Микробиологическим синтезом
50. Реакция окисления калия гексацианоферратом (III) с одновременным гидраминным расщеплением используется в анализе подлинности:
А. Адреналина гидротартрат
| 10-001 | Г | 10-011 | Д | 10-021 | В | 10-031 | Б | 10-041 | Д |
| 10-002 | Д | 10-012 | Б,Г | 10-022 | А | 10-032 | Д | 10-042 | А |
| 10-003 | Б | 10-013 | А,Г,Д | 10-023 | Б | 10-033 | 1-Д 2-Г 3-Б 4-А 5-В | 10-043 | Д |
| 10-004 | Г | 10-014 | А,Г,Д | 10-024 | Б | 10-034 | Д | 10-044 | Д |
| 10-005 | А,В | 10-015 | А | 10-025 | Б,Д | 10-035 | 1-В 2-А 3-Б 4-Д 5-Г | 10-045 | Г |
| 10-006 | Б | 10-016 | А | 10-026 | Г | 10-036 | Б,В | 10-046 | В |
| 10-007 | А | 10-017 | А | 10-027 | Б | 10-037 | А,Д | 10-047 | А |
| 10-008 | Б | 10-018 | Г | 10-028 | Б | 10-038 | Б | 10-048 | А |
| 10-009 | 1-В 2-Б,В 3-А | 10-019 | В | 10-029 | Д | 10-039 | Б,В | 10-049 | А |
| 10-010 | Г | 10-020 | А | 10-030 | Г | 10-040 | А | 10-050 | Б |
Дата добавления: 2016-10-06 ; просмотров: 433 | Нарушение авторских прав
источник
1) Метод неводного титрования (титрант — 0,1 М раствор хлорной кислоты) в среде безводной уксусной кислоты (ФС) [см. задачу № 21]. Индикатор -кристаллический фиолетовый.
2) Метод алкалиметрии (титрант 0,1 М раствор гидроксида натрия в присутствии органического растворителя для растворения выделяющегося основания; индикатор — фенолфталеин).
3. Согласно ФС, кодеина фосфат в таблетках «Пенталгин» идентифицируют с помощью метода ТСХ на пластинках в присутствии свидетелей. Система растворителей: ацетон — толуол — диэтиламин (19,5 : 5 : 0,5). После высушивания пластинку проявляют в УФ-свете. Также используют метод ГЖХ. Кодеина фосфат идентифицируют по времени удерживания.
Количественное содержание кодеина фосфата в данной лекарственной форме определяют методом ВЭЖХ. Расчет количества кодеина фосфата проводят по площадям пиков анализируемого и стандартного образцов.
1. Сульфокамфокаин представляет собой смесь сульфокамфорной кислоты и основания новокаина в соотношении 49,6 : 50,4.
В сухом виде смесь расплывается на воздухе, поэтому применяется в виде 10% водного раствора для инъекций.
Это прозрачная слегка желтоватая жидкость, рН 4,2-5,8.
В структуре сульфокамфокаина содержатся: сульфогруппа, кетогруппа, третичная аминогруппа, первичная ароматическая аминогруппа, сложноэфир-ная группа, ароматическое ядро.
2. Выбор реакций для подтверждения подлинности основывается на наличии перечисленных выше функциональных групп.
Сульфогруппу сульфокамфорной кислоты идентифицируют после минерализации с последующим воздействием концентрированной хлористоводородной кислотой. Образуется сульфат-ион, который обнаруживают с хлоридом бария.
Кетогруппа сульфокамфорной кислоты обнаруживается с помощью реакции взаимодействия с 2,4-динитрофенилгидразином. Образуется желтый осадок:
Новокаин обнаруживают с помощью реакций:
а) образования азокрасителя (на первичную ароматическую аминогруппу) [см. задачу № 9].
б) гидроксамовой пробы (на сложноэфирную группу). Возникает вишневое окрашивание:
в) образование основания Шиффа с альдегидами в присутствии конц. хлористоводородной кислоты (оранжевое окрашивание):
3. Количественное определение сульфокамфокаина проводят по основанию новокаина и кислоте сульфокамфорной.
Основание новокаина количественно определяют нитритометрическим методом. Титрант — 0,1 М раствор нитрита натрия, в присутствии хлористоводородной кислоты, катализатор — бромид калия, индикатор — нейтральный красный. Титруют медленно и на холоду:
Кислоту сульфокамфорную определяют алкалиметрически в присутствии хлороформа. Выделяющееся основание новокаина растворяется в хлороформе и не мешает определению кислоты сульфокамфорной.
Кроме того, известны методики фотоколориметрического определения сульфокамфокаина в растворе для инъекций. С этой целью используются либо реакции образования азокрасителя или гидроксамата железа (определение ведется по новокаину), либо реакция образования гидразона желтого цвета с 2,4-динитрофенилгидразином (определение ведется по аниону кислоты сульфокамфорной).
Салициловый эфир уксусной кислоты
Кислота ацетилсалициловая относится к ненаркотическим анальгетикам. Ацетилсалициловая кислота оказывает противовоспалительное, жаропонижающее и болеутоляющее действие. Применяют при лихорадочных состояниях, головной боли, невралгиях, в качестве противоревматического средства, выпускается в виде таблеток по 0,25 и 0,5 г.
2. По химической структуре кислота ацетилсалициловая относится к производным фенолокислот, является сложным эфиром салициловой и уксусной кислот. По физическим свойствам ацетилсалициловая кислота представляет собой бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом. Кислота ацетилсалициловая мало растворима в воде, но легко растворима в растворах гидроксидов щелочных металлов, этаноле, хлороформе. Поскольку в молекуле лекарственного вещества присутствуют ароматическое кольцо, кислота ацетилсалициловая обладает способностью поглощать электромагнитное излучение и для анализа может быть использован метод УФ-спектрофотометрии.
3. Для испытания подлинности кислоты ацетилсалициловой используют реакцию гидролиза сложно-эфирной группы в кислой или щелочной среде с последующей идентификацией продуктов гидролиза:
При подкислении серной кислотой образуется белый кристаллический осадок салициловой кислоты и появляется запах уксусной кислоты:
Осадок отфильтровывают, а к фильтрату, содержащему уксусную кислоту, прибавляют этанол и концентрированную серную кислоту — образуется ук-сусноэтиловый эфир, обладающий характерным запахом фруктовой эссенции:
Салициловую кислоту, оставшуюся на фильтре, растворяют в этаноле и идентифицируют с помощью раствора хлорида железа (III) по образованию окрашивания. Окраска и состав образующихся комплексов непостоянны и зависят от соотношения лекарственного вещества и реактива, а также от pH среды. При pH 2–3 образуется окрашенный в фиолетовый цвет моносалицилат железа (III), при pH 3–8 — красного цвета дисалицилат, а при pH 8–10 — желтого цвета трисалицилат:
При добавлении к раствору ацетилсалициловой кислоты концентрированной серной кислоты ощущается запах уксусной кислоты. При прибавлении к полученному раствору формалина появляется розовое окрашивание (ауриновый краситель):
Количественное определение ацетилсалициловой кислоты проводят, используя метод нейтрализации 0,1 М раствором натрия гидроксида в предварительно нейтрализованном по фенолфталеину этаноле до розовой окраски раствора:
Кислоту ацетилсалициловую количественно можно определить также с использованием физико-химических методов (УФ-спектрофотометрия).
4. Промышленный способ получения кислоты аскорбиновой основан на синтезе из D-глюкозы, которую восстанавливают в D-сорбит каталитическим гидрированием. Важным этапом синтеза является процесс глубинного бактериохимического окисления (брожения) с помощью Acetobacter suboxydans D-сорбита до L-сорбозы:
При количественном определении ацетилсалициловой кислоты необходимо учитывать влияние димедрола и аскорбиновой кислоты. Все три компонента определяются в сумме методом алкалиметрии. Затем определяют содержание димедрола методом аргентометрии и аскорбиновой кислоты методом иодиметрии. Содержание ацетилсалициловой кислоты вычисляют по разнице объемов натрия гидроксида, серебра нитрата и иода:
KIO3 + 5KI + 6HCl ¾® 3I2 + 6KCl + 3H2O
Если титрование проводится в навесках равной массы и титрованными растворами одинаковой концентрации, то содержание кислоты ацетилсалициловой (X) рассчитывают по формуле:
где: V3 — объем 0,1 М раствора натрия гидроксида, мл;
V2 — объем 0,1 М раствора серебра нитрата, мл;
V1 — объем 0,1 М раствора иода, мл;
f1 — фактор аскорбиновой кислоты;
f2 — фактор ацетилсалициловой кислоты;
Р — общая масса лекарственной формы, г.
6. Кислоту ацетилсалициловую хранят в сухом месте в хорошо укупоренной таре. Во влажном воздухе постепенно гидролизуется с образованием уксусной и салициловой кислот. Салициловая кислота является специфической допустимой примесью. Содержание салициловой кислоты в ацетилсалициловой кислоте определяют методом фотоколориметрии по реакции с 0,2% раствором железоаммониевых квасцов.
Камфора представляет собой белые кристаллические куски или бесцветный кристаллический порошок, или прессованные плитки с кристаллическим строением. Камфора обладает сильным характерным запахом. Практически нерастворима в воде, легко растворима в этаноле, очень легко в эфире, хлороформе, легко в жирных маслах. Камфора образует эвтектические смеси с ментолом, фенолом, тимолом, хлоралгидратом. Камфора образует сублимат, возгоняясь даже при комнатной температуре, флуоресцирует в УФ-свете.
2. По химической структуре камфора относится к бициклическим терпенам — производным углеводорода камфана. Ввиду наличия в молекуле камфоры двух асимметрических атомов углерода, существуют оптические изомеры d-, 1-и рацемическая камфора. Температура плавления, затвердевания, кипения и значение удельного вращения служат константами, подтверждающими подлинность камфоры. Также для идентификации камфоры используют цветные реакции с фурфуролом или бензальдегидом:
Наличие в молекуле камфоры кетогруппы обусловливает возможность проведения качественных реакций с образованием осадков или окрашенных продуктов:
2,4-динитрофенилгидразон камфоры имеет определенную температуру плавления, являющуюся константой и используемую для подтверждения подлинности камфоры.
Для количественного определения камфоры используют оксимный способ, основанный на взаимодействии камфоры с определенным количеством гидроксиламина гидрохлорида:
Нерастворимый в воде оксим определяют гравиметрическим методом или титруют выделившееся эквивалентное количество хлористоводородной кислоты.
Для испытания подлинности и количественного определения камфоры применяют также метод ГЖХ.
Хранят камфору в плотно укупоренных склянках оранжевого стекла в прохладном, защищенном от света месте, учитывая способность камфоры возгоняться.
Магния сульфат. Magnesii sulfas
Магния сульфат относится к седативным лекарственным средствам. При парантеральном введении в зависимости от дозы, может наблюдаться седатив-ный, снотворный или наркотический эффект. При пероральном применении магния сульфат оказывает послабляющее и желчегонное действие. При внутривенном введении 20-25% растворов — седативное, противосудорожное, спазмолитическое действие.
2. Магния сульфат — бесцветные призматические выветривающиеся кристаллы, легко растворим в воде и практическим нерастворим в этаноле.
3. Подлинность магния сульфата можно подтвердить по образованию нерастворимого в воде, но растворимого в уксусной кислоте осадка фосфата магния-аммония:
Наличие сульфат-иона обнаруживают по реакции с раствором бария хлорида, наблюдая образование белого осадка сульфата бария.
4. Количественное определение магния сульфата проводят прямым ком-плексонометрическим титрованием в среде аммиачного буферного раствора (индикатор — кислотный хром-черный). Титрант 0,05 М раствор трилона Б [см. задачу № 2].
5. Лекарственные средства для парантерального применения должны быть стерильными, практически свободными от видимых механических включений. Инъекционные растворы могут быть изотоничными, изогидричными и изоионичными в соответствии с требованиями нормативной документации.
Лекарственные средства для парантерального применения готовят в условиях, максимально предотвращающих загрязнение готового продукта микроорганизмами и посторонними веществами (асептические условия).
Растворы для инъекций и инфузий до стерилизации подвергаются полному химическому контролю. После стерилизации растворов проводят посерийный контроль по внешнему виду, значению рН, подлинности и количественному содержанию каждого ингредиента. От каждой серии отбирается 1 флакон. Контроль на стерильность и испытания на пирогенность растворов для инъекций и инфузий проводят согласно ГФ XI, а контроль на механические включения в соответствии с инструкцией, включающей первичный и вторичный контроль. Первичный контроль (до стерилизации) осуществляется после фильтрования и фасовки растворов (100% флаконов). Вторичному контролю подлежат все 100% флаконов, которые прошли стадию стерилизации.
Асептически приготовленные растворы просматривают только один раз после розлива или стерилизующего фильтрования.
Инъекционные растворы должны отвечать требованиям нормативной документации по разделам: описание, подлинность, прозрачность, цветность, объем заполнения, механические включения, пирогенность, количественное определение.
По химической структуре дигитоксин относится к группе стероидных О-гликозидов (карденолиды). В медицинской практике дигитоксин применяют при сердечной недостаточности. Формы выпуска — таблетки по 0,0001 г и суппозитории по 0,000015 г. Особенностью дигитоксина является выраженный кумулятивный эффект. По фармакологическому действию относится к кардиото-ническим средствам.
2. Молекула дигитоксина состоит из агликона, имеющего стероидную структуру и являющегося производным циклопентанфенантрена, и сахарной части, связанных между собой гликозидной связью. Гликозидная связь является специфичной для данной группы соединений и представляет собой простую эфирную группировку. Сахарная часть в молекуле дигитоксина состоит из трех молекул D-дигитоксозы:
3. Дигитоксин представляет собой белый кристаллический порошок, практически нерастворим в воде, мало — в этаноле. Поскольку в молекуле дигитоксина присутствуют асимметрические атомы углерода подлинность препарата можно установить по значению удельного вращения. Объективную оценку подлинности позволяет сделать ИК-спектр. Возможно использование УФ-спектрофотометрии для идентификации и количественного определения дигитоксина.
Стероидный цикл в молекуле препарата обнаруживают по реакции Ли-бермана-Бурхардта. Образуется зеленое окрашивание. Пятичленный лактонный цикл открывают по реакции с нитропруссидом натрия в щелочной среде (реакция Легаля) — красное окрашивание, с раствором пикриновой кислоты (реакция Балье) дигитоксин образует оранжево-красное окрашивание:
Дигитоксин хранят по списку А в хорошо укупоренной таре, предотвращающей воздействие света и влаги, способствующих гидролитическому расщеплению.
Этиловый эфир ди-(4-оксикумаринил-3)-уксусной кислоты
Неодикумарин относится к группе препаратов антикоагулянтов непрямого действия и применяется для длительного снижения свертывания крови в целях профилактики и лечения тромбозов, тромбофлебитов, инсультов, инфарктов.
2. Неодикумарин очень мало растворим в воде, мало растворим в этаноле, растворим в растворах гидроксидов щелочных металлов. Наличие хромофорных (кетогруппа, сопряженные двойные связи) и ауксохромных (гидроксильные группы) фрагментов позволяет использовать для анализа лекарственного вещества методы, основанные на поглощении электромагнитного излучения УФ-спектрофотометрию, фотоколориметрию. Подлинность и количественное содержание препарата можно также определить методами ВЭЖХ и ИК-спектроскопии. Так как неодикумарин имеет два спиртовых гидроксила, подлинность также можно установить по температуре плавления диацетата неодикумарина.
3.По химическому строению неодикумарин относится к производным 4-оксикумарина и содержит в своей структуре 2 гетероциклические системы кумарина с оксигруппой в положении 4, связанные между собой метиленовой группой. Кумарин, в свою очередь включает лактонный цикл. При сплавлении со щелочью происходит разрыв лактонного цикла с образованием салицилат-иона, который с раствором хлорида железа (III) образует сине-фиолетовое окрашивание:
При нагревании с 0,1 М раствором натрия гидроксида лактонный цикл неодикумарина раскрывается с образованием фенола, который открывают по реакции получения азокрасителя.
После щелочного гидролиза образуется этанол, который открывают по образованию йодоформа.
4.Количественное определение неодикумарина выполняют гравиметрическим методом после образования диацетата неодикумарина:
Осадок отделяют и высушивают до постоянной массы. Содержание неодикумарина вычисляют по формуле:
где: g2 — масса гравиметрической формы, г;
g1 — масса неодикумарина, взятая на анализ, г;
F — гравиметрический фактор.
По эквивалентно выделившемуся количеству уксусной кислоты можно определить содержание неодикумарина методом нейтрализации (параллельно проводят контрольный опыт). Титрант — 0,1 М раствор натрия гидроксида. Ин-дикатор — фенолфталеин. Расчет содержания неодикумарина проводят по формуле:
где: V — объем 0,1 М раствора натрия гидроксида, пошедшего на титрование уксусной кислоты, мл;
Vk — объем титранта, пошедшего на титрование в контрольном опыте, мл;
а — масса неодикумарина, взятая на анализ, г.
Метод нейтрализации используют и для прямого титрования раствора неодикумарина в ацетоне:
В этом методе используют смешанный индикатор (метиловый красный и метиленовый синий). Содержание неодикумарина рассчитывают по формуле:
4. Неодикумарин хранят по списку А в плотно укупоренной таре темного стекла, в прохладном, защищенном от света месте, предотвращая разрушение препарата, связанное с разрывом лактонного цикла и гидролизом сложноэфир-ной группы.
2. Оба вещества являются производными алкилуреидов сульфокислот. Бутамид является и-метилпроизводным, а букарбан — п-аминопроизводным.
Показателями качества по НД являются физические свойства. Бутамид и букарбан представляют собой белые кристаллические вещества. Они практически нерастворимы в воде, растворимы или мало растворимы в этаноле. Ввиду наличия в молекулах сульфамидной группы, они проявляют кислотные свойства и растворимы в растворах щелочей.
Для идентификации бутамида и букарбана используют ИК-спектроскопию. ИК-спектры лекарственных веществ в вазелиновом масле регистрируют в области 4000-650 см»1. Они должны соответствовать спектрам стандартных образцов.
Подлинность бутамида и букарбана можно установить методом УФ-сгтсктрофотометрии по расположению максимумов поглощения и по удельному показателю поглощения в 0,1 М растворе кислоты хлороводородной и 0,1 М растворе натрия гидроксида.
Так как лекарственные вещества являются производными мочевины, подлинность бутамида и букарбана устанавливают также с помощью групповых химических реакций
При нагревании бутамида в растворе гидроксида калия происходит гидролиз с образованием аммиака, который можно обнаружить по запаху или по изменению окраски лакмусовой бумаги:
Аналогичный химический процесс происходит при испытании в тех же условиях букарбана.
Реакция гидролиза происходит при кипячении бутамида или букарбана с кислотой серной разбавленной. Последующее добавление 30%-ного раствора гидроксида натрия приводит к выделению жирных капель аминов, имеющих характерный запах. После более продолжительного нагревания (10-30 мин) в присутствии 50%-ной серной кислоты (с обратным холодильником), последующего охлаждения и нейтрализации выделяется осадок сульфамида.
Наличие серы устанавливают после минерализации. Плав растворяют в кислоте хлороводородной и в фильтрате открывают сульфат-ион.
Растворы бутамида и букарбана при нагревании с 0,2%-ным раствором нингидрина в бутиловом спирте приобретают фиолетовое окрашивание.
Букарбан отличается от бутамида наличием первичной ароматической аминогруппы в молекуле. Способы его испытаний по этой функциональной группе такие же, как и при анализе сульфаниламидов. Для испытания подлинности используют реакцию диазотирования и азосочетания с р-нафтолом в щелочной среде. Появляется красное окрашивание.
3. Количественное определение букарбана проводят по первичной ароматической аминогруппе нитритометрическим методом, устанавливая точку эквивалентности с помощью потенциометра, внешнего или внутренних индикаторов. Букарбан можно количественно определять и бромид-броматометрическим методом.
Количественное определение бутамида проводят методом алкалиметрии. В качестве растворителя применяют диметилформамид, титрантом служит раствор гидроксида натрия (калия), индикатором—тимолфталеин:
Количественное определение бутамида и букарбана проводят методом неводного титрования в среде безводной уксусной кислоты, используя в качестве титранта 0,1 М раствор хлорной кислоты, устанавливая конечную точку титрования потенциометрическим методом, т. к. эти вещества являются слабыми основаниями [см. задачу № 21].
Бутамид и букарбан в лекарственных формах количественно определяют методом УФ-спектрофотометрии в 0,1 М растворе натрия гидроксида.
4. При несоблюдении условий хранения возможен гидролиз лекарственных веществ с образованием сульфонилмочевины или мочевины. Содержание этих примесей определяют методом ВЭЖХ. Хранят лекарственные вещества в сухом, защищенном от света месте, при температуре до 25 °С по списку Б.
Класс соединений: конденсированные производные β-лактамидов тиазо-лидина (пенициллины).
Фармакологическая группа: химиотерапевтические средства — антибиотики группы пенициллина.
Формы выпуска: порошок (натриевая соль) во флаконах 0,25 и 0,5 г; таблетки (в виде тригидрата) по 0,25 г или 0,5 г.
Получение: ампициллин — полусинтетический пенициллин. Процесс получения включает стадии биологического и органического синтеза:
1) Биосинтез бензилпенициллина.
2) Получение 6-аминопенициллановой кислоты (гидролиз пенициллинови выделение 6-АПК).
3) Ацилирование 6-аминопенициллановой кислоты.
2. Молекула ампициллина содержит остаток 6-аминопенициллановой кислоты (6-АПК) и фениламиноацетат. Наличие асимметрических атомов углерода (*) обусловливает оптическую активность молекулы. Определение удельного вращения используется для подтверждения подлинности ампициллина. Бензольное кольцо обусловливает избирательное поглощение в УФ-области спектра. Спектр поглощения в области длин волн 260-280 нм используют для установления подлинности. ИК-спектр, измеряемый в области от 4000 до 400 см’1,также используют для подтверждения подлинности ампициллина.
а) по реакции с хромотроповой кислотой в присутствии серной кислоты концентрированной.
б) наличие β-лактамного цикла позволяет получить гидроксаматы меди или железа (III) [см. задачу № 20].
в) органически связанную серу обнаруживают после минерализации с натрия гидроксидом до сульфид-иона: с нитропруссидом натрия — красно-фиолетовое окрашивание; с ацетатом свинца — черный осадок [см. задачу №20].
г) наличие фениламиноуксусной кислоты подтверждают реакцией с нингидрином [см. задачу № 5].
д) взаимодействие с солями меди приводит к получению комплекса фиолетового цвета — доказывает наличие первичной алифатической аминогруппы:
а) Иодиметрический метод. Сущность метода заключается в том, что продукты гидролиза (пенальдиновая кислота и пеницилламин) окисляются иодом [см. задачу № 20].
б) Спектрофотометрическое определение в УФ-области используется как метод альтернативный химическому для количественного определения ампициллина. Метод заключается в измерении спектров поглощения продуктов гидролиза, имеющих максимум поглощения при 320-324 и 335 нм:
4.Под действием кислорода и влаги воздуха возможно гидролитическое разрушение р-лактамного цикла и потеря антимикробной активности, поэтому ампициллин хранят в виде порошков во флаконах, укупоренных пробками и обжатыми алюминиевыми колпачками.
5.«Уназин» содержит ампициллина натриевую соль и сульбактам (ингибитор Р-лактамаз).
При совместном применении фармакологический (антимикробный) эффект обеспечивает ампициллин, сульбактам подавляет действие Р-лактамазы, предохраняя ампициллин от разрушения.
6. Вещества, нарушающие синтез клеточной стенки, в частности ампициллин, обладают выраженным антимикробным действием и практически не влияютна клетки макроорганизма. Считают, что пенициллины, в частности ампициллин,нарушают разные этапы синтеза клеточной стенки, препятствуя образованию пептидных связей за счет ингибирования фермента транспептидазы.
Ампициллин, по сравнению с бензилпенициллином, устойчив в кислой среде желудка, у него выше всасываемость из ЖКТ, он действует на грамположи-тельные и грамотрицательные микроорганизмы. Он неактивен только в отношении пенициллиназообразующих стафилококков. Пенициллин, в отличие от него, неустойчив в кислой среде желудка. Близкими по действию к «Уназину» являются следующие препараты: «Сультасин» (содержит ампициллин и сульбактам натрия; выпускается в виде порошка для инъекций) и «Панклав» (содержит амоксициллин и клавулановую кислоту, которая также является ингибитором β-лактамазы).
7. «Уназин» выпускают в виде таблеток, порошка для инъекций, суспензии для приема внутрь.
По фармакологическому действию является антибактериальным химио-терапевтическим средством.
2. Наличие бензольного ядра и нитрогруппы обусловливает избирательное поглощение в УФ-области спектра: водный раствор левомицетина имеет максимум поглощения при 278 нм. Качественной характеристикой является удельный показатель поглощения.
Спектр поглощения в ИК-области также используется для установления подлинности вещества.
Молекула содержит асимметрические атомы углерода (*) и поэтому обладает оптической активностью. Удельное вращение является качественной характеристикой левомицетина. Фармакологичекой активностью обладает лево-вращающий изомер.
Гидролиз левомицетина в щелочной среде позволяет доказать наличие в молекуле ароматической нитрогруппы, аминогруппы и органически связанного хлора:
Левомицетин взаимодействует с сульфатом меди с образованием комплексного соединения синего цвета.
Ароматическая нитрогруппа обнаруживается по образованию азокраси-теля после восстановления ее до аминогруппы цинковой пылью в среде серной
кислоты. Одновременно отщепляется органически связанный хлор, который в виде хлорид-иона обнаруживается в растворе по реакции с нитратом серебра:
Нитритометрическое определение после предварительного восстановления нитрогруппы до первичной ароматической аминогруппы (реакцию см. выше).
Конечную точку титрования определяют с помощью внешнего индикатора: иодкрахмальной бумаги [см. задачу № 9].
4. Так как одним из побочных эффектов антибиотиков является развитие дисбактериозов, поэтому сочетание антибиотиков и нормофлоров целесообразно. Антибактериальная активность антибиотиков распространяется как на патогенную микрофлору, так и на нормальную микрофлору. Пробиотики предотвращают дисбактериозы.
Нормофлоры изготавливают из живых активных бактерий, являющихся представителями нормальной микрофлоры кишечника человека: кишечной палочки, бифидобактерий, лактобактерий.
При приеме внутрь содержащиеся в лекарственных препаратах — нормоф-лорах живые антагонистически активные микроорганизмы заселяют кишечник, способствуя нормализации биоценоза и, как следствие этого, восстановлению пищеварительной, обменной и защитной функции кишечника.
Причиной диареи путешественников является нарушение микрофлоры кишечника, следовательно, предпочтительным является применение нормофлоров.
Теобромин и теофиллин являются спазмолитическими средствами. Теобромин используется при резко выраженных спазмах сосудов головного мозга, теофиллин применяют в качестве бронхолитического, умеренно действующего кардиотонического и диуретического средства.
Оба вещества — это производные ксантина, который является конденсированной системой, состоящей из двух гетероциклов: пиримидина и имидазола. Отличаются вещества заместителями у N1 и N7 атомов азота. Оба вещества являются алкалоидами и содержат третичные аминогруппы.
2. Подлинность теобромина и теофиллина можно установить по ИК-спектрам поглощения в диапазоне от 4000 до 400 см»1. Наличие системы п-сопряженных двойных связей в пуриновом цикле обусловливает избирательное поглощение растворов обоих веществ в УФ области спектра с максимумами поглощения около 272 нм. Кроме того, идентифицировать теобромин и теофиллин можно методом ВЭЖХ с УФ-детектированием.
3. Наличие третичных аминогрупп в молекулах рассматриваемых веществдает возможность проведения реакций с оеадительными алкалоидными реактивами (раствор иода, реактив Шейблера, реактив Драгендорфа).
Общегрупповой реакцией для алкалоидов производных пурина является мурексидная проба [см. задачу № 2].
Реакции отличия
Теофиллин и теобромин обладают кислотными свойствами (отличие от кофеина), так как имеют атом водорода в 7- и 1-положениях соответственно. На этих особенностях химического строения основаны реакции с хлоридом кобальта и нитратом серебра с получением осадков различного цвета и консистенции:
б) Аналогично протекают реакции с теофиллином [см. задачу № 8]. Методы количественного определения основаны на кислотно-основных свойствах теобромина и теофиллина.
Теобромин имеет электронодонорную группу -СН3 в положении 7, что усиливает слабоосновные свойства атома азота в 9 положении и позволяет проводить определение теобромина как слабого органического основания методом неводного титрования в среде муравьиной кислоты и уксусного ангидрида.
На кислотных свойствах обоих веществ основан метод заместительной нейтрализации после взаимодействия с серебра нитратом:
Все вышеописанные методы количественного определения применимы для анализа субстанций теобромина и теофиллина.
В лекарственных формах, содержащих теобромин и теофиллин, количественное определение этих производных пурина, чаще всего, проводят методом ВЭЖХ, спектрофотометрическим методами или объемными химическими методами: иодиметрически (теобромин), алкалиметрически (косвенная нейтрализация) (теофиллин).
Папаверина гидрохлорид Дротаверина гидрохлорид
Papaverini hydrochloridum Drotaverine Hydrochloride
6,7-диметокси-1 -(3′,4′- 1-(3,4-диэтоксибензилиден)-
Оба препарата являются производными бензилизохинолина, относятся к группе спазмолитических средств. Получают синтетическим путем, природный папаверин получают из опия. Формы выпуска: в таблетках по 0,04 и 2% раствор в ампулах по 2 мл.
Лекарственные вещества отличаются по внешнему виду. Папаверина гидрохлорид — белый кристаллический порошок. Дротаверина гидрохлорид — свето-желтый или зеленовато-желтый кристаллический порошок. Растворимы в воде оба вещества, так как являются гидрохлоридами. рН растворов слабокислая. Растворы обоих веществ должны быть прозрачными.
Так как продукты деструкции этих веществ окрашены в желтый цвет, поэтому нормирование цветности растворов является необходимым.
Оба вещества являются органическими азотистыми основаниями, производными бензилизохинолина, и вступают в реакции с общеалкалоидными оса-дительными (А) и специальными (Б) реактивами:
А. Реактив Драгендорфа, реактив Шейблера, реактив Майера. Результатами этих реакция являются осадки, окрашенные в различные цвета.
Б. Кислота азотная концентрированная, кислота серная концентрированная, реактив Марки, реактив Фреде, реактив Эрдмана, реактив Манделина. В результате этих реакция образуются окрашенные или флюоресцирующие продукты.
Из физико-химических методов анализа для идентификации возможно использование ИК-спектроскопии в диапазоне 4000 — 400 см -1 .
| ЗАДАЧА 36 |
| NaO3S-CH2 |
Растворы обоих веществ в различных растворителях характеризуются избирательным поглощением в диапазоне длин волн от 220 до 350 нм, что используется для идентификации папаверина и дротаверина.
источник
