В 3 главе рассмотрим применение спектрометрических и фотоколореметрических методов в анализе лекарственных средств таких как Левомицетин, Новокаин, Фурацилин, Метилтестостерон, Преднидазол, Прогестерон.
В медицинской практике нашел широкое применение антибиотик хлорам-феникол или его синтетический аналог левомицетин, — ароматическое соединение, производное нитрофенилалкиламина:
Как было установлено, левомицетин представляет собой D-(-)-mpeo—n-нитрофенил-2-дихлорацетиламино-пропандиол-1,3.
Левомицетин относится к D-ряду как и конфигурационный стандарт D-гли-цериновый альдегид:
Определение подлинности. Для определения подлинности левомицетина проводят реакцию щелочного гидролиза при нагревании, наблюдая образование соединения кирпично-красного цвета. Присутствие алифатической аминогруппы и спиртового гидроксида объясняет возможность образования окрашенных комплексных соединений с солями тяжелых металлов.
Находящаяся в молекуле левомицетина нитрогруппа может быть восстановлена цинковой пылью в кислой среде до аминогруппы. Образующееся ами-носоединение диазотируют и превращают в азокраситель в результате реакции азосочетания, например с р-нафтолом:
Для определения аминопроизводного левомицетина можно использовать любую реакцию, применяемую для амидов сульфаниловой кислоты. Так, при реакции конденсации с альдегидами образуется продукт, окрашенный в желто-оранжевый цвет (основание Шиффа):
Подлинность левомицетина может быть определена физико-химическими методами: методом инфракрасной спектрометрии или хроматографически.
Определение примесей. Хлорамфеникол, используемый для приготовления инъекционных форм, должен быть протестирован на содержание бактериальных эндотоксинов.
Количественное определение. Для количественного определения левомицетина используют спектрофотометрию в ультрафиолетовой области (спиртовые растворы, Хтах = 272 нм).
Возможно применение броматометрии (бромирование ароматического ядра), фотоколориметрии (образование азокрасителя после восстановления нитро-группы). Кроме того, после восстановления нитрогруппы может быть применен метод нитритометрии.
Для эфиров левомицетина возможно фотоколориметрическое определение в виде окрашенных гидроксаматов железа.
Являясь сложным эфиром новокаин при взаимодействии с гидроксиламином в щелочной среде образует гидроксамовые кислоты:
Выполняя гидроксамовую реакцию следует строго соблюдать требования методики т.к. она дает положительные результаты только при определенном значении рН
Подлиность производных 5-нитрофурана устанавливают по цветной реакции с водным раствором гидроксида натрия.Структура образующихся продуктов находится в зависимости от условий проведения реакции, осбености химического строения 5- нитрофурана,температуры,растворителя и концентрации реактива. Нитрофуран при использовании растворов разбавленных щелочей образует ацисоль , окрашенную в оранжево-красный цвет:
При нагревании нитрофурала в растворах гидроксидов щелочных металлов происходит разрыв фуранового цикла и образуется карбонат натрия , гидразин и аммеак.Последний обнаруживают по изменению окраски влажной лакмусовой бумаги:
Реакцию осаждения 2,4-денитрофенилгидразона используют для количественного определения прогестерона и для испытания его подлиности
Тестостерона пропионат и метилтестостерон , содержащие в положении 3 кетонную группировку , при действии гидроксиламином образуют оксимы с температурой плавления соответственно 166-171 и 210-216 градусов по цельсию. Оксим метилтестостерона образуется по схеме:
Метандиенон идентифицируют по образованию гидразона (окрашенного в оранжево-красный цвет) при взаимодействии с 2,4-динитрофенилгидразином:
При нагревании на водяной бане смеси спиртового раствора кортикостироида и реактива Фелинга выпадает красно-оранжевый осадок. Реакция обусловлена восстановленными свойствами а- кетольной группировки которая легко окисляется до карбоксильной:
В присутствии реактива Фелинга:
Восстанавливающие свойства а-кетольной группы лежат в основе реакции «серебряного зеркала», которое образую ряд кортикостероидов (кортизона ацетат, гидрокортизон, преднизолон):
Кортикостероиды, содержащие а-кетольную группу (кортизон и его аналоги), дают цветную реакцию, основанную! окислении 0,5%-ным раствором хлорида трифенилтетразолия в этаноле в присутствии 10%-ного раствора гидроксидая траметиламмония. Появляется красная окраска, обусловленная образованием формазана:
источник
Для проведения аналитического контроля и заключения о качестве лекарственного вещества и возможных лекарственных форм:
бел. крист. пор. со слаб. желтов-зел. отт. кр. пор., б/з , горьк. вкуса, м.р. в воде, л.р, в спирте.
Антибиотик ароматического ряда. Производное хлорамфеникола. Сп. Б
Применяется от брюшного тифа, бруцеллёза, сальманелиоза, гангрены, пневмонии
Мол-ла левомецетина включ. 2 асимметричных атома углерода, п/э возможно существование 4 простых изомеров : Д-трео, α-трео, Д-эритро, α-эритро.
Подлинность (чистота):
1. опт. акт-ть – исп. коэф. уд-го вращения. Активно поглощает свет и имеет
3. спектрофотометрия при λ=278 нм
4. кислотность (добавляют спирт, нейтрализованный по ФФ, перемешивают, фильтруют – должна появлятся розовая окраска после одной капли 0,1 М NaOH).
5. ТБ пост. примеси ТСХ не более 3х дополнительных пятен. Сульфатная зола, тяжелые металлы – в субстанции и ЛФ.
Содержит функциональные гр: Ar нитрогруппу, ковалентно связанный Hal, спиртовый гидроксил
Качественные реакции:
1. Гидролиз в щелочной среде.
Осадок отфильтровывают, затем:
NaCl + AgNO3 AgCl¯ + NaNO3
2. Раствор левомицетина в спирте вращает плоскость поляризации света влево
3. Таб, капсулы: УФ СФМ при 230-250 нм.
1. Образование медного комплекса.
2. Образование азокрасителя с бета-нафтолом после восстановления аминогруппы цинков в кислой среде
Количественное определение:
а. Нитритометрия (после восстановления NH2 группы).
Навеску + HCl + Zn – охлаждают, титруют NaNO2 с KBr. Индикатор – йод-крахмальная бумага.
2 KI + 2NaNO2 + 4HCl à I2 + 2NO + 2NaCl + 2KCl + 2H2O f=1
б. УФ СФМ в водном растворе.
1. Куприметрия прямая. Мурексидная индикаторная смесь. Титрант: CuSO4. Титруют до перехода окраски от фиолетово к коричнево-красной. f=2.
2 Левомицетина + CuSO4 à (Левомицетин)2Cu + H2SO4
2Левомицетина + CuSO4 + 4NaOH à (Левомицетин) 2Cu + Na2SO4 + 4H2O
CuSO4изб + 2NaOH à Cu(OH)2¯ + Na2SO4 (отфильтровывают осадок)
(Левомицетин)2Cu + H2SO4 разб à 2Левомицетина + CuSO4
2CuSO4 + 4KI à Cu2I2 + 2K2SO4 + I2
I2 + 2Na2S2O3 à 2NaI + Na2S4O6
, F=2
3. Аргентометрия по Фольгарду.
Левомицетин + H2O2 + 2 NaOH à 2 NaCl + …
Минерализуют при кипячении в течении 1 часа; затем подкисляют HNO3, добавляют избыток AgNO3. Титруют роданидом аммония с индикатором квасцами. F=1/2
4. Меркуриметрия. Минерализация таким же образом, подкисляют HNO3, титруют нитратом ртути 2 с дифенилкарбазоном. Фактор=1/2
5. УФ СФМ в составе комплексных ЛФ (РСО готовят из субстанции левомицетина).
6. ФЭК по реакции азосочетания.
Хранение: Список Б (сильнодействующее), ХУТ оранжевого стекла в темном сухом месте.
Лек. формы: таблетки 0,25 и 0,5; капс. с лев-м 0,25 и 0,5; гл. капли 0,25% на изотонич. р-ре NaCl либо 2% бром. к-ты
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 8181 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Антибиотики, относящиеся к этой группе, являются в основном производными бензола. Одним из представителей таких антибиотиков является хлорамфеникол (хлоромицетин) -■ природный антибиотик и его синтетический аналог левомице-
Левомицетин (хлорамфеникол) ^aevomycetinum (Chloramphenicolum)
Хлорамфеникол продуцируется почвенным актиномицетом, Act. venezuelae.
Штамм этого продуцента был впервые выделен из почв Венесуэлы (1947), откуда он и получил свое название.
Хлорамфеникол — антибиотик широкого спектра действия. Он действует не только против грамположительных ихрамотри-цательных бактерий, но и риккетсий, вызывающих заболевания, которые не поддавались воздействию ранее известных антибиотиков и других лекарственных средств — брюшной и сыпной тифы, бруцеллез, холера и др.
Такой широкий диапазон действия антибиотика привлек к нему большое внимание исследователей и в течение двух лет было не только изучено его химическое строение, но и осуществлен синтез (1949, США).
Почти одновременно в Советском Союзе академик М. М. Шемякин с группой сотрудников провели большую работу по синтезу аналогов хлорамфеникола и изучению связи между его строением и антибиотическим действием.
При этом оказалось, что биологическая активность хлорам^ феникола находится в очень большой зависимости от пространственной конфигурации молекулы.
С помощью спектрального анализа была установлена принадлежность хлорамфеникола к производным /г-замещенных: нитробензолов.
При гидролизе хлорамфеникола получается соединение, со* держащее аминогруппу — основание хлорамфеникола (I) и ди—хлоруксусная кислота (Н):
При конденсации полученных продуктов снова получается хлорамфеникол (III), молекула которого структурно изображается следующим образом.
Хлорамфеникол имеет 2 асимметрических атома углерода, поэтому возможно существование’ четырех стереоизомеров или двух пар антиподов: D (-) и L ( + ) треоизомера (со строением транс) и D (-) и L ( + ) эритроизомера (со строением цис 1 ). Отличаются они пространственным расположением ОН- и Н-групп у первого углеродного атома боковой цепи.
Оба изомера эритроформы очень токсичны и в медицине не применяются.
После установления химического строения хлорамфеникола был осуществлен его синтез сначала американскими исследователями (1949), а затем советскими (1980).
Это был первый химический синтез антибиотика, получаемого в промышленных масштабах, и до сих пор это один из немногих антибиотиков, получаемый путем химического синтеза.
При химическом синтезе получается рацемический препарат, т. е. соединение, содержащее L ( + ) трео- и D-(-) треоформы хлорамфеникола. Рацемический препарат, синтезированный советскими химиками, был назван синтомицином, из которого затем был выделен его левовращающий изомер D-(-)-треофор-ма, который был назван левомицетином.
Синтомицин обладает 50% биологической активности лево-мицетина и в настоящее время в медицине не применяется.
Фармакопейными препаратами являются левомицетин и ле-вомицетина с^еарат.
Левомицетик представляет собой белый или белый со слабым желтовато-хеленоватым оттенком кристаллический порошок без запаха, Горького вкуса. Препарат мало растворим в воде, легко в спирте^ нерастворим в хлороформе.
Для подтверждения подлинности препарата ГФ X рекомендует реакцию со щелочью при нагревании, при этом появляется сначала желтое окрашивание, переходящее при дальнейшем нагревании в красно-оранжевое. При кипячении раствора окраска усиливается, выпадает осадок кирпично-красного цвета, обусловленный образованием азобензойной кислоты. Кроме того, образуются n-нитробензальдегид и n-нитробензиловый спирт.
После отделения осадка в фильтрате, подкисленном азотной кислотой, определяется ион С1
путем добавления раствора нитрата серебра.
При кипячении препарата со щелочью дихлоруксусная кислота отщепляет хлор, который в щелочной среде образует хлорид натрия, последний и дает с раствором нитрата серебра белый творожистый осадок хлорида серебра.
Левомицетин является оптически деятельным соединением, поэтому для него характерно удельное вращение, которое должно быть от +18 до i+21° (5% раствор в 95% спирте). Следует отметить, что раствор препарата в этилацетате вращает плоскость поляризованного луча влево, а спиртовой раствор — вправо.
Для подтверждения подлинности левомицетина можно привести и другие реакции, например, реакцию, основанную на восстановлении левомицетина до аминопроизводного. Послед-
нее диазотируется и сочетается в щелочной среде с ^-нафтолом с образованием азокрасителя красного цвета.
Количественное содержание левомицетина в препарате ГФХ рекомендует проводить методом нитритометрии после восстановления (при нагревании) нитрогруппы цинковой пылью в присутствии хлороводородной кислоты (см. «Амиды сульфани-ловой кислоты»).
Предложены и другие методы определения, основанные на химических свойствах препарата: броматометрия (бромируется ароматическое ядро), колориметрия (основана на образовании азокрасителей после восстановления нитрогруппы), аргентомет-рия (определение иона хлора после щелочного гидролиза). Из физико-химических методов могут быть использованы спектро-фотометрия и поляриметрия.
Левомицетин применяется при лечении брюшного тифа и паратифа, дизентерии, бруцеллеза, коклюша, туляремии, гонореи, сыпного тифа и других заболеваний, вызываемых вирусами. При длительном применении левомицетина могут возникнуть грибковые поражения кожи и слизистых оболочек полости рта, зева (кандидамикоз), кожные сыпи, дерматиты.
Назначается левомицетин внутрь. Выпускается в порошке, таблетках, покрытых оболочкой, капсулах, в виде свечей и 1% мази.
Недостатком левомицетина является его горький вкус, что ограничивает его применение, например в детской практике. Это отрицательное свойство левомицетина можно устранить преобразованием антибиотика в различные эфиры. Получены эфиры левомицетина с угольной, серной, пальмитиновой, стеариновой, янтарной и другими кислотами.
Из них применяется в медицине и является фармакопейным препаратом левомицетина стеарат.
источник
Порошок растертых таблеток в количестве около 0,8 г (точная навеска) растворяют при нагревании в 10 мл ледяной уксусной кислоты, после охлаждения добавляют 5 мл предварительно нейтрализованного раствора ацетата натрия и титруют 0,1 н. раствором хлорной кислоты до голубого окрашивания (индикатор кристаллический фиолетовый).
1 мл 0,1 н. раствора хлорной кислоты соответствует 0,02017 г С10Н15NО∙HCl, которого должно быть 0,0225-0,-275 г, считая на среднюю массу одной таблетки.
Тема № 7 — Анализ лекарственных средств нитрофенилалкиламинов: левомицетин и его эфиры (3 часа)
Цель: Анализ лекарственных средств нитрофенилалкиламинов в соответствии с требованиями государственной фармакопеи
Задачи обучения: ознакомление с группой нитррофенилалкиламинов в ряду фенилалкиламинов, изучение физико-химических свойств, знакомство с общими требованиями государственной фармакопеи по контролю качества левомицетина и его эфиров.
Основные вопросы темы:
- Виды изомерии в ряду нитрофенилалкиламинов.
- Антибиотики ароматического ряда.
3. Методы испытания лекарственных средств производных нитрофенилалкиламинов.
5. Синтетический способ получения антибиотиков.
6. Лекарственные формы и применение их в медицинской практике.
Методы обучения и преподавания: информация по основным вопросам темы занятия
1.Руководство к лабораторным занятиям по фармацевтической химии: Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. – М.: Медицина, 2001. – 384 с.
2.Лабораторные работы по фармацевтической химии /Под ред. В.Г. Беликова. – М.: Высшая школа, 1989. – 375 с.
3. Государственная фармакопея Республики Казахстан: первое издание. – Астана: Изд. дом «Жибек жолы», 2008. – 592 с.
4.Государственная фармакопея СССР, ХI издание. – М.: Медицина, 1987.
Контроль (вопросы, ситуационные задачи и тесты):
1.Какие физические и химические свойства характерны для левомицетина и его эфиров?
2.Какими химическими реакциями можно подтвердить подлинность левомицетина и левомицетина стеарата?
3.Укажите особенности нитритометрического титрования производных нитрофенилалкиламинов.
4.Какие возможные методы существуют для определения адреналина, норадреналина и их солей?
5.Какие методы количественного определения можно предложить для анализа изадрина, фенотерола, сальбутамола?
6.Какое фармакологическое действие имеет эфедрина гидрохлорид?
7.Какие условия хранения допускаются для лекарственных препаратов группы фенилалкиламинов?
1.Укажите антибиотический лекарственный препарат, который изучается в группе нитрофенилакиламинов …
C) норадреналина гидротартрат;
2.Общую реакцию с раствором натрия гидроксида ГФ Х издания предлагает на …
E) натрия пара-аминосалицилат.
- Количественное определение левомицетина и левомицетина стеарата выполняют методом …
A) аргентометрического титрования;
B) нитритометрического титрования;
C) нейтрализации в водной среде;
D) броматометрического титрования;
E) иодометрического титрования.
4. Левомицетина стеарат гидролизуется в присутствии концентрированной соляной кислоты являясь …
5. В каких методах используется реакция азосочетания левомицетина?
6. В культуральной жидкости какого гриба обнаружен левомицетин?
A) Penicillinum Chrysogenum;
E) Streptomyces venezuelae.
Задание 1. Выполнить испытание на подлинность и на чистоту препарата – левомицетина.
Подлинность:
А) К 0,1 г препарата прибавляют 5 мл раствора едкого натра и нагревают; появляется желтое окрашивание, переходящее при дальнейшем нагревании в красно-оранжевое. При кипячении этого раствора окраска усиливается, выделяется кирпично-красный осадок и появляется запах аммиака. Фильтрат после подкисления азотной кислотой дает характерную реакцию на хлориды.
К 2 мл раствора хлорида (около 0,002 г иона хлорида) прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра; образуется белый творожистый осадок, растворимый в растворе аммиака. Для солей органических оснований испытание растворимости образовавшегося осадка хлорида серебра проводят после отфильтровывания и промывания осадка водой.
Б) Раствор препарата в 95% спирте вращает плоскость поляризации вправо, в этилацетате – влево.
Испытания на чистоту:
От + 18 0 до + 21 0 (5 % раствор в 95 % спирте).
К 1 г препарата прибавляют 2 мл нейтрализованного по фенолфталеину спирта, хорошо перемешивают в течение 1 минуты и фильтруют. Фильтрат после прибавления 2 капель раствора фенолфталеина и 0,05 мл 0,1 н. раствора едкого натра должен окраситься в розовый цвет, не исчезающий в течение 3 минут.
0,3 г препарата взбалтывают в течение 1 минуты с 15 мл воды и фильтруют. 10 мл фильтрата должны выдерживать испытание на тяжелые металлы (не более 0,001 % в препарате).
— сульфатная зола и тяжелые металлы
Сульфатная зола из 0,5 г препарата не должна превышать 0,1 % и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).
Задание 2. Выполнить определение растворимости, подлинности и испытание на чистоту лекарственного препарата – Laevomycetini stearas.
Растворимость:
Практически нерастворим в воде, трудно растворим в 95 % спирте, легко растворим в хлороформе и ацетоне с образованием во всех случаях мутных растворов.
Подлинность:
К 0,2 г препарата прибавляют 5 мл раствора едкого натра и кипятят в течение 1-2 минут; поялвяется красно-оранжевое окрашивание.
0,1 г препарата помещают в коническую колбу емкостью 50 мл, прибавляют 10 мл концентрированной серной кислоты и нагревают на сетке в течение 5 минут. На поверхность всплывают маслянистые капли, затвердевающие при охлаждении.
Испытание на чистоту:
— определение примеси свободной стеариновой кислоты
Около 0,5 г препарата (точная навеска) помещают в коническую колбу емкостью 50 мл и растворяют при нагревании на водяной бане в 25 мл 95% спирта, нейтрализованного по фенолфталеину. По охлаждении раствор титруют 0,1 н. раствором едкого натра с тем же индикатором.
1 мл 0,1 н. раствора едкого натра соответствует 0,02845 г стеариновой кислоты, которой должно быть не более 3,0%.
Задание 3. Выполнить количественное определение лекарственного препарата – Laevomycetinum и сделать соответствие лекарственного препарата условиям хранения:
Дата добавления: 2015-08-29 ; просмотров: 1835 . Нарушение авторских прав
источник
Окислительно-восстановительное титрование.
Броматометрия, или броматометрическое титрование, — метод определения восстановителей путем титрования стандартным раствором бромата калия KBrO3.
Сущность метода. В основе метода лежит полуреакция
BrO3 — + 6e + 6H + = Br — + 3H2O
Стандартный ОВ потенциал редокс-пары BrO3 — ,H + ,|Br — при комнатной температуре равен 1,44 В, т.е. имеет довольно высокое значение. Поэтому бромат калия в кислой среде является сильным окислителем и способен окислять многие восстановители.
В соответствии с вышеприведенной полуреакцией фактор эквивалентности бромат-иона в ОВ процессах такого типа равен f( 1 /z)=f( 1 /n) = 1 /6. Молярная масса эквивалента бромата калия в подобных ОВ реакциях равна
Молярная концентрация с(KBrO3) и молярная концентрация эквивалента с( 1 /6 KBrO3) связаны соотношением
Титрант метода. В качестве титранта метода применяют водный
раствор KBrO3, чаще всего с молярной концентрацией эквивалента 0,1
моль/л. Титрант можно готовить по точной навеске кристаллического
бромата калия марки «х.ч», высушенного до постоянной массы при
При необходимости титрант стандартизуют иодометрически или по оксиду мышьяка (III).
Индикаторы метода. Раствор титранта — бромата калия — бесцветен. Образующиеся в ОВ процессе бромид-ионы также бесцветны. При броматометрическом титровании после достижения ТЭ первая же избыточная капля титранта взаимодействует с бромид-ионами с образованием брома:
BrO3 — + 5Br — + 6H + = 3Br2 + 3H2O (1)
Образующийся бром окрашивает раствор в бледно-желтый цвет. Эта окраска, однако, недостаточно интенсивна для визуальной фиксации КТТ. Поэтому броматометрическое титрование ведут в присутствии индикаторов, например метилового оранжевого, метилового красного, нейтрального красного, которые в кислой среде окрашивают титруемый раствор в красный цвет. После достижения ТЭ такие азоиндикаторы необратимо бромируются бромом, образующимся после ТЭ согласно вышеприведенной реакции, вследствие чего раствор обесцвечивается: титрование прекращают.
Титрование ведут медленно во избежание локального образования
брома в растворе до достижения ТЭ.
При описанном способе броматометрически титруют вещества, которые являются более эффективными восстановителями, чем бромид-ионы. Прибавляемый титрант вначале окисляет эти вещества. Только после того, как они полностью прореагируют с броматом калия, последний начинает окислять бромид-ионы. Образуется бром, вступающий в реакцию с индикатором, бромируя его, вследствие чего раствор и обесцвечивается.
Часть титранта расходуется на реакцию с индикатором, поэтому в броматометрии обычно проводят холостое титрование раствора, содержащего такое же количество индикатора, что и анализируемый раствор.
Количество титранта, израсходованное на холостое титрование, вычитают из общего количества титранта, затраченного на титрование анализируемого раствора.
Условия проведения броматометрического титрования. В броматометрии учитывают, по крайней мере, следующие обстоятельства.
1) Влияние кислотности раствора. Реальный ОВ потенциал редокс-пары BrO3 — ,Н + |Вr — сильно зависит от концентрации водородных ионов:
и увеличивается с понижением рН раствора. Поэтому броматометрическое титрование рекомендуется проводить в сильнокислой среде.
С учетом изложенного броматометрическое титрование проводят в
растворах хлороводородной кислоты с концентрацией не ниже 1 моль/л.
2) Влияние температуры. ОВ реакции с участием бромат-ионов часто протекают медленно. Для увеличения скорости реакций растворы нагревают до
3) Влияние катализаторов. В ряде случаев реакции броматометрического окисления ускоряются в присутствии солей ртути (II).
Применение броматометрии. Броматометрическое титрование используют для определения олова(II), мышьяка(III), сурьмы(III) железа(II), пероксида водорода, нитритов, тиоицианатов, гидразина, фенилгидразина, гидроксиламина, семикарбазида, тиокарбамида, щавелевой кислоты, в количественном анализе фармацевтических препаратов, таких как АsO3, мышьяксодержащие новарсенол, миарсенол, аминарсон, осарсол, после их минерализации и перевода в соединения мышьяка(III).
Дата добавления: 2014-01-04 ; Просмотров: 7335 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Лекарственные средства этой группы являются производными бензола. Вначале из почвенных актиномицетов был выделен хлорамфеникол, антибиотик широкого спектра действия. Затем был синтезирован препарат, содержащий его L- иD-изомеры этого вещества, который назвали синтомицином. Активностью обладаетD-изомер. Его в дальнейшем выделили и назвали левомицетином.
HNHCOCHCl2
Физические свойства. Представляет собой белый или бело=желтоватый порошок кристаллический порошок без запаха, горького вкуса. Препарат мало растворим в воде, легко – в этаноле, нерастворим в хлороформе.
Испытание на подлинность. При нагревании с раствором гидроксида натрия появляется желтое окрашивание переходящее в красно-оранжевое. При кипячении раствора окраска усиливается и выпадаеи осадок кирпично-красного цвета вследствие образования азобензойной кислоты. Из-за расщепления амидной группы ощущается запах аммиака. За счет двух ковалетно связанных атомов хлора в цепочке образуются хлорид-ионы. Их после отделения осадка определяют в фильтрате при помощи раствора нитрата серебра. Спиртовый раствор левомицетина вращает на поляриметре плоскость поляризованного вправо, а этилацетатный раствор – влево. Проводят также реакцию восстановления левомицетина до аминопроизводного. Последнее диазотируется в щелочной среде с β-нафтолом с образованием азокрасителя красного цвета.
Количественное определение содержания левомицетина в препарате проводят методом нитрометрии после восстановления при нагревании нитрогруппы цинковой пылью в присутствии хлористоводородной кислоты. Определяют его также методом бромированиябензольного цикла (броматометрия), выявления хлорид-иона после щелочного гидролиза (аргентометрия) и фотоэлектроколориметрически по образованию азокрасителей после восстановления нитрогруппы.
Применяетсядля лечения людей и животных, больных тифом, дизентенрией, бруцеллезом и другими заболеваниями. Выпускается в порошке или таблетках по 0,25 г.
Хранитсяв хорошо укупоренной посуде при комнатной температуре. Список В.
Вещества этой группы представляют собой сочетание основания стрептидина, содержащего два остатка гуанидина, с содержащим N-метильную группу дисахаридом стрептобиозоамином. Последний состоит из пентозы стрептозы и гексозыN-метилглюкозамина. Альдегидная группа стрептозы может модифицироваться с образованием производных, обладающих лечебным эффектом.
Замедляет рост возбудителей туберкулеза, бруцеллеза, брюшного тифа и др.
Свойства. Представляет собой порошок белого цвета горьковатого вкуса. Легко растворим в воде, практически не растворим в метаноле, этаноле, хлороформе и эфире. Устойчив в слабокислой среде, к действию воздуха и света, но легко разрушается под действием щелочей и кислот при нагревании.
Испытание на подлинность. 1. Определяют сульфат-ион обычной реакцией. 2. Проводят мальтозную пробу: к 0,5% раствору препарата добавляют 0,5 н раствор едкого натрия, нагревают, охлаждают и приливают 1% раствор железоаммониевых квасцов в 1 н растворе серной кислоты, образуется фиолетовой окрашивание. 3. к 0,5% раствору препарата в растворе едкого натра приливают 0,05% раствор α-нафтола в 40% этаноле, охлаждают до температуры 15 0 С, добавляют несколько капель 5% раствора натрия гипобромида – развивается фиолетовое окрашивание.
Испытание на чистоту.рН 28% раствора должен равняться 4,5-7. Этот раствор после стояния в течение суток при комнатной температуре должен оставаться прозрачным и бесцветным. Проводят испытание на токсичность, стерильность, пирогенность и содержание гистаминоподобных веществ.
Количественное определение проводят биологическим методом с использованием диффузии в агар.
Хранение. Выпускают в герметических флаконах, в которых должно содержаться не менее 90% единиц, указанных на этикетке. Хранят в сухих помещениях при температуре не выше 20 0 С.
источник
Раздел 4. II. Специальная фармацевтическая химия. Органические лекарственные вещества. Ароматические соединения
В процессе хранения глазных капель сульфацил-натрия от действия света и кислорода воздуха может наблюдаться:
| сдвиг рН в кислую сторону |
| появление осадка |
| изменение удельного вращения |
| +пожелтение раствора |
| сдвиг рН в щелочную сторону |
Анализируемый образец стрептоцида соответствует требованиям ФС по показателю «Температура плавления» (должно быть от 164 до 167 о С) при получении следующих результатов определения:
| 163-165 о С |
| 164-167 о С |
| +165-167 о С |
| 166-168 о С |
| 168-169 о С |
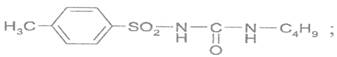
В качестве специфической примеси в новокаине может быть:
| пара-аминосалициловая кислота |
| фенол |
| пара-аминофенол |
| салициловая кислота |
| +пара-аминобензойная кислота |
Дифференцировать сульфаниламиды можно, применяя в качестве реактива:
| +сульфат меди |
| бромную воду |
| нитрат кобальта |
| нитрит натрия, раствор хлороводородной кислоты и в-нафтол |
| нитрат серебра |
Общей при идентификации резорцина и норсульфазола является реакция с раствором:
| гидроксиламина |
| меди сульфата |
| нитрата кобальта |
| кислоты сульфосалициловой |
| +хлорида железа (III) |
Для ацетилсалициловой кислоты, новокаина, валидола общей является реакция:
| образования азокрасителя |
| +гидроксамовой пробы |
| с хлорамином |
| с хлоридом железа (III) |
| с бромной водой |
Азокраситель не образуют лекарственные вещества производные:
| сульфаниламидов |
| +бензойной кислоты |
| вторичных ароматических аминов |
| ортоаминобензойной кислоты |
| парааминобензойной кислоты |
Лекарственные средства группы сульфаниламидов не стандартизируются по показателю:
| прозрачность и цветность |
| кислотность и щелочность |
| +удельное вращение |
| растворимость |
| тяжелые металлы |
Нитроглицерин, анестезин, валидол имеют в структуре одинаковую функциональную группу:
| +сложноэфирную |
| гидроксильную |
| спиртовую |
| первичную ароматическую |
| третичную аминогруппу |
Количественное определение методом броматометрии можно выполнить для следующих лекарственных веществ, кроме:
| новокаина |
| +натрия бензоата |
| анестезина |
| резорцина |
| стрептоцида |
Метод иодиметрии (в вариантах прямого, обратного, заместительного титрования) применяют для количественного определения лекарственных веществ, кроме:
| натрия нитрита |
| хлоралгидрата |
| +серебра нитрата |
| стрептоцида |
| резорцина |
Метод ацетилирования применяется для количественного определения:
| кислоты ацетилсалициловой |
| формальдегида |
| +глицерина |
| резорцина |
| стрептоцида |
Для количественного определения стрептоцида можно применить методы, кроме:
| ацидиметрии в среде ледяной уксусной кислоты |
| +перманганатометрии |
| иодиметрии |
| броматометрии |
| нитритометрии |
Для установления наличия ароматической нитрогруппы в молекуле левомицетина используют реакции:
| восстановление до ароматической аминогруппы |
| конденсация с ароматическими альдегидами |
| реакция с хлоридом железа (III) |
| с реактивом Марки |
| +восстановление до ароматической аминогруппы с последующим образованием азокрасителя |
При количественном определении нитритометрическим методом левомицетина стеарата после его восстановления в качестве внешнего индикатора используют:
| тропеолин 00 |
| метиловый красный |
| метиловый оранжевый |
| бромфеноловый синий |
| +иодкрахмальную бумагу |
Титрование 0,1 М раствором хлорной кислоты необходимо проводить в присутствии ацетата ртути (II) при определении:
| +морфина гидрохлорида |
| атропина сульфата |
| хинина сульфата |
| кодеина |
| резерпина |
Плоскость поляризации способны вращать:
изониазид  |
никотинамид  |
кислота никотиновая  |
фурацилин  |
+ левомицетин  |
Легко растворимо в воде лекарственное вещество:
| +новокаин; |
| кислота ацетилсалициловая; |
| тимол; |
| фенилсалицилат. |
Образование азокрасителя с солью диазония без предварительного гидролиза возможно для:
| +новокаина; |
| тримекаина; |
| парацетамола; |
| кислоты бензойной. |
Гидроксамовая проба может быть применена для идентификации:
| тимола; |
| +новокаина; |
| натрия бензоата; |
| резорцина. |
Производным ацетанилида является:
| +парацетамол; |
| галоперидол; |
| анестезин; |
| +тримекаин. |
Сложными эфирами являются:
| тетрациклин; |
| +прозерин; |
| натрия салицилат; |
| +галоперидола деканоат. |
Амидная группа имеется в химической структуре:
| тимола; |
| анестезина; |
| фенилсалицилата; |
| +тримекаина. |
В реакции комплексообразования с солями тяжелых металлов вступают:
| +натрия n-аминосалицилат; |
| новокаин; |
| +натрия салицилат; |
| +парацетамол. |
Броматометрия может быть использована для количественного определения:
| тримекаина; |
| +парацетамола; |
| +натрия салицилата; |
| кислоты бензойной. |
Нитритометрия может быть использована для количественного определения:
| +новокаина; |
| тимола; |
| резорцина; |
| викасола. |
К производным нитрофенилалкиламинов относится:
| норадреналин; |
| леводопа; |
| +левомицетин; |
| трийодтиронин. |
Антибактериальным ЛС широкого спектра действия является:
| анаприлин; |
| +левомицетин; |
| эфедрина гидрохлорид; |
| леводопа. |
Практически нерастворим в воде:
| адреналина гидротартрат; |
| эфедрина гидрохлорид; |
| +изадрин; |
| левомицетина стеарат. |
По величине удельного вращения анализируют:
| +эфедрин; |
| адреналина гидротартрат; |
| +левомицетин; |
| +трийодтиронин. |
Являются альфа -аминоспиртами:
| +адреналин; |
| леводопа; |
| +норадреналин; |
| дийодтирозин. |
Являются альфа-аминокислотами:
| адреналин; |
| +леводопа; |
| норадреналин; |
| +дийодтирозин. |
Основные свойства выражены в большей степени у:
| адреналина; |
| норадреналина; |
| +эфедрина; |
| изадрина. |
Являясь азотистыми основаниями, лекарственные вещества группы арилалкиламинов взаимодействуют с:
| солями Сu 2+ ; |
| натрия нитритом; |
| +общеалкалоидными реактивами; |
| альфа-нафтолом. |
В реакцию нингидриновой пробы вступают:
| эфедрин; |
| +леводопа; |
| левомицетин; |
| +метилдофа. |
Как лекарственное вещество эфедрин применяется в виде:
| +L-эритро-формы; |
| D-эритро-формы; |
| L-трео-формы; |
| +D-трео-формы. |
Изумрудно-зеленое окрашивание появляется при добавлении к раствору раствора железа (III) хлорида:
| +адреналина гидротартрата; |
| изадрина; |
| левомицетина; |
| эфедрина гидрохлорида. |
Отличить адреналина гидротартрат от норадреналина гидротартрата можно по:
| растворимости в воде; |
| +реакции окисления при различных значениях рН; |
| реакциям с общеалкалоидными осадительными реактивами |
| реакции с железа (III) хлоридом. |
Количественное определение адреналина гидротартрата можно проводить методами:
| +кислотно-основного титрования в неводных средах; |
| окислительно-восстановительного титрования; |
| +УФ-спектрофотометрии; |
| +ФЭК. |
Количественное определение левомицетина можно проводить методами:
| +нитритометрии; |
| +аргентометрии; |
| броматометрии; |
| определения азота по Кьельдалю. |
Добавление ртути (II) ацетата требуется при количественном определении методом кислотно-основного титрования в среде кислоты уксусной ледяной (титрант — 0,1 М раствор кислоты хлорной):
| адреналина гидротартрата; |
| +эфедрина гидрохлорида; |
| норадреналина гидротартрата; |
| +изадрина. |
К производным амида сульфаниловой кислоты не относятся:
| сульфацил-натрий; |
| сульфален; |
| +бутамид; |
| фталазол. |
Производными амида хлорбензолсульфоновой кислоты являются:
| стрептоцид; |
| фуросемид; |
| +пантоцид; |
| +хлорамин Б. |
В разбавленных кислотах и щелочах растворяются:
| фуросемид; |
| +букарбан; |
| фталазол; |
| +стрептоцид. |
Растворимость фталазола в растворах щелочей обусловлена :
| +карбоксильной группой; |
| имидной группой; |
| +амидной группой; |
| аминогруппой. |
Стрептоцид растворимый и сульфацил-натрий можно различить по:
| +значению рН водного раствора; |
| +реакции образования азокрасителя; |
| растворимости в воде; |
| +продуктам гидролитического разложения. |
Для отличия дихлотиазида от фуросемида используются реакции:
| +гидролитического разложения; |
| +диазотирования и азосочетания; |
| с меди сульфатом; |
| доказательство наличия хлорид-иона после минерализации вещества. |
Для стабилизации глазных капель сульфацил-натрия используются реагенты:
| +кислота хлороводородная; |
| натрия гидроксид; |
| +натрия тиосульфат; |
| трилон Б. |
При длительном стоянии водного раствора сульфацил-натрия наблюдаются изменения, обусловленные соответствующим типом реакции:
| +гидролизом; |
| полимеризацией; |
| +окислением; |
| восстановлением. |
Образование окрашенного продукта с кислотой салициловой в присутствии кислоты серной концентрированной характерно для лекарственного вещества:
 |
 |
 |
 |
Образование окрашенного продукта с кислотой хромотроповой в присутствии кислоты серной концентрированной характерно для:
| бутамида; |
| стрептоцида; |
| +дихлотиазида; |
| пантоцида. |
Не дают окрашенных продуктов при пиролизе:
| +фуросемид; |
| сульгин; |
| +стрептоцид; |
| бутамид. |
Для количественного определения сульфаниламидов наиболее целесообразным объемным методом является:
| метод нейтрализации; |
| метод йодиметрии; |
| +метод нитритометрии; |
| метод аргентометрии. |
Количественное определение фталазола проводится методом кислотно-основного титрования в среде:
| кислоты уксусной ледяной; |
| уксусного ангидрида; |
| +диметилформамида; |
| кислоты муравьиной. |
При фотометрическом определении сульфаниламидов по реакции образования азокрасителя наиболее целесообразно использовать азосоставляющую:
| фенол; |
| альфа-нафтол; |
| бета-нафтол; |
| +N-(1-нафтил)этилендиамин. |
При нитритометрическом количественном определении сульфалена необходимо соблюдение следующих условий:
| +регламентирование скорости титрования; |
| +соблюдение температурного режима; |
| предварительное гидролитическое разложение; |
| использование обратного способа титрования |
Метод цериметрии применяют для количественного определения:
| бутамида; |
| салазопиридазина; |
| +дихлотиазида; |
| сульфадиметоксина. |
Общая реакция для резорцина и норсульфазола:
| пиролиз; |
| с раствором железа (III) хлорида; |
| +получение азокрасителя; |
| с раствором нитрата кобальта; |
с раствором меди сульфата.
В виде трео- и эритро-стереоизомеров может существовать:
| леводопа; |
| папаверина гидрохлорид; |
| +левомицетин; |
| кодеин; |
Термической стерилизации не подвергают инъекционный раствор:
| новокаина; |
| +адреналина гидрохлорида; |
| глюкозы; |
| кислоты никотиновой; |
Реакция сульфохлорирования ароматических углеводородов, широко используемая при синтезе амидов сульфокислот, относится к реакциям:
Все перечисленные лекарственные вещества (ацетилцистеин, ибупрофен, леводопа) содержат в химической структуре:
первичную алифатическую аминогруппу;
Количественное определение эфедрина гидрохлорида проводят методом:
+кислотно-основного титрования в среде муравьиной кислоты и уксусного ангидида;
ацидиметрии в водной среде;
КУРС, 8 СЕМЕСТР
Дата добавления: 2016-07-29 ; просмотров: 1821 | Нарушение авторских прав
источник
21. Другие виды ОВ титрования.ppt
БРОМАТОМЕТРИЯ Титрант – 0, 1 моль/л раствор KBr. O 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-1.jpg» alt=»> БРОМАТОМЕТРИЯ Титрант – 0, 1 моль/л раствор KBr. O 3″ /> БРОМАТОМЕТРИЯ Титрант – 0, 1 моль/л раствор KBr. O 3 Можно приготовить по точной навеске Br. O 3 + 6 H+ + 6ē Br + 3 H 2 O М(1/6 KBr. O 3) = М(KBr. O 3)/6
Стандартизация иодометрическим методом KBr. O 3 + 6 KI + 3 H 2″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-2.jpg» alt=»> Стандартизация иодометрическим методом KBr. O 3 + 6 KI + 3 H 2″ /> Стандартизация иодометрическим методом KBr. O 3 + 6 KI + 3 H 2 SO 4 3 I 2 + 3 K 2 SO 4 + +KBr + 3 H 2 O I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 С(Na 2 S 2 O 3)пр V(Na 2 S 2 O 3) С(1/6 KBr. O 3)пр = V(1/6 KBr. O 3) С(1/6 KBr. O 3)пр K = С(1/6 KBr. O 3)тр Хранят в темном месте, в склянках темного стекла
Прямая броматометрия применяется для к. о. оксида мышьяка (III): » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-3.jpg» alt=»>Прямая броматометрия применяется для к. о. оксида мышьяка (III): » /> Прямая броматометрия применяется для к. о. оксида мышьяка (III): 3 As 2 O 3 + 2 KBr. O 3 3 As 2 O 5 + 2 KBr В т. э. KBr. O 3 +5 KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Изб. капля изб. капля Ind – метиловый красный (обесцвечивается)
БРОМОМЕТРИЯ Титрант – раствор брома, получают из бромат- бромидной смеси» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-4.jpg» alt=»> БРОМОМЕТРИЯ Титрант – раствор брома, получают из бромат- бромидной смеси» /> БРОМОМЕТРИЯ Титрант – раствор брома, получают из бромат- бромидной смеси KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Из бюретки добавляют стандартный раствор бромата калия (бромометрию часто называют броматометрией). В фарманализе прямая бромометрия применя- ется для к. о. тимола, стрептоцида (реакция электрофильного замещения) и др. препаратов.
Тимол: KBr. O 3 + KBr + 3 H 2 SO 4 » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-5.jpg» alt=»>Тимол: KBr. O 3 + KBr + 3 H 2 SO 4 » /> Тимол: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Ind–метиловый красный (обесцв. изб. капля Br 2) C 21– – 4 е C 21+
m(Тим) = V(KBr. O 3)·K·T(KBr. O 3/Тим) V(KBr.» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-6.jpg» alt=»> m(Тим) = V(KBr. O 3)·K·T(KBr. O 3/Тим) V(KBr.» /> m(Тим) = V(KBr. O 3)·K·T(KBr. O 3/Тим) V(KBr. O 3)·K·T(KBr. O 3/Тим)· 100 (Тим) = ———————, % а(Тим) С(1/6 KBr. O 3) М(1/4 Тим) Т(KBr. O 3/Тим) = 1000
Стрептоцид: KBr. O 3 + KBr + 3 H 2 SO 4 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-7.jpg» alt=»>Стрептоцид: KBr. O 3 + KBr + 3 H 2 SO 4 3″ /> Стрептоцид: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Индикатор – метиловый красный C 21– – 4 е C 21+ С(1/6 KBr. O 3) М(1/4 Стр) Т(KBr. O 3/Стр) = 1000
Обратная бромометрия с иодометрическим окончанием применяется для количественного определения фенола, резорцина,» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-8.jpg» alt=»>Обратная бромометрия с иодометрическим окончанием применяется для количественного определения фенола, резорцина,» /> Обратная бромометрия с иодометрическим окончанием применяется для количественного определения фенола, резорцина, кислоты салициловой, новокаина (реакция электрофильного замещения), изониазида (реакция окисления) и др. препаратов
Фенол: KBr. O 3 + KBr + 3 H 2 SO 4 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-9.jpg» alt=»>Фенол: KBr. O 3 + KBr + 3 H 2 SO 4 3″ /> Фенол: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O избыток Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 Ind – крахмал
C 31– – 6 е C 31+ » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-10.jpg» alt=»> C 31– – 6 е C 31+ » /> C 31– – 6 е C 31+ (VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Фен 100 (Фен)= (%) а(Фен) С(Na 2 S 2 O 3) М(1/6 Фен) Т(Na 2 S 2 O 3/Фен) = 1000
Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-11.jpg» alt=»>Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3″ /> Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Фен 100 (Фен)= (%) а(Фен)
Резорцин: KBr. O 3 + KBr + 3 H 2 SO 4 » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-12.jpg» alt=»>Резорцин: KBr. O 3 + KBr + 3 H 2 SO 4 » /> Резорцин: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O избыток Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
(VKBr. O 3 K VNa 2 S 2 O 3 K)» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-13.jpg» alt=»> (VKBr. O 3 K VNa 2 S 2 O 3 K)» /> (VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Рез 100 (Рез)= (%) а(Рез) С(Na 2 S 2 O 3) М(1/6 Рез) Т(Na 2 S 2 O 3/Рез) = 1000 Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Рез 100 (Рез)= (%) а(Рез)
Кислота салициловая: KBr. O 3 + KBr + 3 H 2 SO 4 » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-14.jpg» alt=»>Кислота салициловая: KBr. O 3 + KBr + 3 H 2 SO 4 » /> Кислота салициловая: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 C 31– – 6 е C 31+
(VKBr. O 3 K VNa 2 S 2 O 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-15.jpg» alt=»> (VKBr. O 3 K VNa 2 S 2 O 3″ /> (VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал) С(Na 2 S 2 O 3) М(1/6 Сал) Т(Na 2 S 2 O 3/Сал) = 1000 Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал)
Новокаин: C 21– – 4 е C 21+ С(Na» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-16.jpg» alt=»>Новокаин: C 21– – 4 е C 21+ С(Na» /> Новокаин: C 21– – 4 е C 21+ С(Na 2 S 2 O 3) М(1/4 Нов) Т(Na 2 S 2 O 3/Нов) = 1000
Изониазид: KBr. O 3 + KBr + 3 H 2 SO 4 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-17.jpg» alt=»>Изониазид: KBr. O 3 + KBr + 3 H 2 SO 4 3″ /> Изониазид: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O избыток Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
N 22– – 4 е N 20 » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-18.jpg» alt=»> N 22– – 4 е N 20 » /> N 22– – 4 е N 20 С(Na 2 S 2 O 3)·M(1/4 Изн) Т(Na 2 S 2 O 3/Изн) = ————— 1000 m(Изн) = (VKBr. O 3 K VNa 2 S 2 O 3 K) Т(Na 2 S 2 O 3/ Изн) (VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Изн 100 (Изн)= (%) а (Изн)
Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-19.jpg» alt=»>Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3″ /> Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Изн 100 (Изн)= (%) а(Изн)
ИОДХЛОРМЕТРИЯ Титрант – 0, 1 М раствор йодмонохлорида ICl + 2″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-20.jpg» alt=»> ИОДХЛОРМЕТРИЯ Титрант – 0, 1 М раствор йодмонохлорида ICl + 2″ /> ИОДХЛОРМЕТРИЯ Титрант – 0, 1 М раствор йодмонохлорида ICl + 2 е I– + Cl– М(1/2 ICl) = М(ICl)/2 Приготовление: смешивают рассчитанное количество KI и KIO 3 в солянокислой среде и добавляют хлороформ 2 KI + KIO 3 + 6 HCl 3 ICl + 3 KCl + 3 H 2 O
Если хлф. слой – фиолетовый избыток I– KI + ICl» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-21.jpg» alt=»>Если хлф. слой – фиолетовый избыток I– KI + ICl» /> Если хлф. слой – фиолетовый избыток I– KI + ICl I 2 + KCl по каплям добавляют KIO 3 до обесцвечивания хлф. слоя Если хлф. слой – бесцветный м. б. избыток IO 3– по каплям добавляют KI до слабо-розовой окраски хлф. слоя
Стандартизацию раствора ICl проводят по стандартному раствору тиосульфата натрия: ICl» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-22.jpg» alt=»>Стандартизацию раствора ICl проводят по стандартному раствору тиосульфата натрия: ICl» /> Стандартизацию раствора ICl проводят по стандартному раствору тиосульфата натрия: ICl + KI I 2 + KCl I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 С(Na 2 S 2 O 3)пр V(Na 2 S 2 O 3) С(1/2 ICl)практ = V(ICl) С(1/2 ICl)пр K = С(1/2 ICl)теор
Прямая иодхлорметрия применяется для количественного анализа восстановителей: кислоты аскорбиновой, гидразина и его» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-23.jpg» alt=»>Прямая иодхлорметрия применяется для количественного анализа восстановителей: кислоты аскорбиновой, гидразина и его» /> Прямая иодхлорметрия применяется для количественного анализа восстановителей: кислоты аскорбиновой, гидразина и его производных и т. д.
Кислота аскорбиновая: ICl + KI I 2 + KCl» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-24.jpg» alt=»>Кислота аскорбиновая: ICl + KI I 2 + KCl» /> Кислота аскорбиновая: ICl + KI I 2 + KCl изб. капля Индикатор – крахмал C 21+ – 2 е C 22+
m(Аск) = V(ICl)·K·T(ICl /Аск) V(ICl)·K·T(ICl /Аск)· 100 (Аск)» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-25.jpg» alt=»> m(Аск) = V(ICl)·K·T(ICl /Аск) V(ICl)·K·T(ICl /Аск)· 100 (Аск)» /> m(Аск) = V(ICl)·K·T(ICl /Аск) V(ICl)·K·T(ICl /Аск)· 100 (Аск) = ——————, % а(Аск) С(1/2 ICl)·M(1/2 Аск) Т(ICl /Аск) = ————— 1000
Обратная иодхлорметрия применяется для количественного определения антипирина , фенола,» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-26.jpg» alt=»>Обратная иодхлорметрия применяется для количественного определения антипирина , фенола,» /> Обратная иодхлорметрия применяется для количественного определения антипирина , фенола, резорцина, кислоты салициловой, стрептоцида и др.
Антипирин: ICl + KI I 2 + KCl» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-27.jpg» alt=»>Антипирин: ICl + KI I 2 + KCl» /> Антипирин: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 C 1– – 2 е C 1+
(VICl K VNa 2 S 2 O 3 K) ТNa 2″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-28.jpg» alt=»> (VICl K VNa 2 S 2 O 3 K) ТNa 2″ /> (VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Ант 100 (Ант)= (%) а(Ант) С(Na 2 S 2 O 3) М(1/2 Ант) Т(Na 2 S 2 O 3/Ант) = 1000
Фенол: ICl + KI I 2 + KCl» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-29.jpg» alt=»>Фенол: ICl + KI I 2 + KCl» /> Фенол: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 C 31– – 6 е C 31+
(VICl K VNa 2 S 2 O 3 K) ТNa 2″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-30.jpg» alt=»> (VICl K VNa 2 S 2 O 3 K) ТNa 2″ /> (VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Фен 100 (Фен)= (%) а(Фен) С(Na 2 S 2 O 3) М(1/6 Фен) Т(Na 2 S 2 O 3/Фен) = 1000
Кислота салициловая: ICl + KI I 2 +» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-31.jpg» alt=»>Кислота салициловая: ICl + KI I 2 +» /> Кислота салициловая: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
(VICl K VNa 2 S 2 O 3 K) ТNa 2″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-32.jpg» alt=»> (VICl K VNa 2 S 2 O 3 K) ТNa 2″ /> (VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал) С(Na 2 S 2 O 3) М(1/4 Сал) Т(Na 2 S 2 O 3/Сал) = 1000 Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал)
Стрептоцид: ICl + KI I 2 + KCl» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-33.jpg» alt=»>Стрептоцид: ICl + KI I 2 + KCl» /> Стрептоцид: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
(VICl K VNa 2 S 2 O 3 K) ТNa» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-34.jpg» alt=»> (VICl K VNa 2 S 2 O 3 K) ТNa» /> (VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Стр 100 (Стр)= (%) а(Стр) С(Na 2 S 2 O 3) М(1/4 Стр) Т(Na 2 S 2 O 3/Стр) = 1000
ИОДАТОМЕТРИЯ Титрант – 0, 1 М раствор иодата калия KIO 3″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-35.jpg» alt=»> ИОДАТОМЕТРИЯ Титрант – 0, 1 М раствор иодата калия KIO 3″ /> ИОДАТОМЕТРИЯ Титрант – 0, 1 М раствор иодата калия KIO 3 Можно приготовить по точной навеске IO 3 + 6 H+ + 6ē I + 3 H 2 O М(1/6 KIO 3) = М(KIO 3)/6 Прямая иодатометрия применяется для к. о. кислоты аскорбиновой:
Кислота аскорбиновая: KIO 3 + 5 KI + 3 H 2 SO 4″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-36.jpg» alt=»>Кислота аскорбиновая: KIO 3 + 5 KI + 3 H 2 SO 4″ /> Кислота аскорбиновая: KIO 3 + 5 KI + 3 H 2 SO 4 3 I 2 + 3 K 2 SO 4 + 3 H 2 O Изб. капля Индикатор – крахмал
V(KIO 3)·K·T(KIO 3/Аск)· 100 (Аск) = ———————, % » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-37.jpg» alt=»> V(KIO 3)·K·T(KIO 3/Аск)· 100 (Аск) = ———————, % » /> V(KIO 3)·K·T(KIO 3/Аск)· 100 (Аск) = ———————, % а(Аск) С(1/6 KIO 3)·M(1/2 Аск) Т(KIO 3/Аск) = ————— 1000
ЦЕРИМЕТРИЯ Титрант – 0, 1 М и 0, 01 М» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-38.jpg» alt=»> ЦЕРИМЕТРИЯ Титрант – 0, 1 М и 0, 01 М» /> ЦЕРИМЕТРИЯ Титрант – 0, 1 М и 0, 01 М сернокислые растворы Ce(SO 4)2 Ce 4+ + ē Ce 3+ Готовят титрант приблизительно нужной концентрации Стандартизация по тиосульфату натрия: 2 Ce(SO 4)2 + 2 KI I 2 + Ce 2(SO 4)3 + K 2 SO 4 I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
В фарманализе прямая цериметрия применяется для к. . железа ( II ),» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-39.jpg» alt=»>В фарманализе прямая цериметрия применяется для к. . железа ( II ),» /> В фарманализе прямая цериметрия применяется для к. . железа ( II ), аскорбиновой кислоты о викасола , токоферола ацетата и др. лекарственных препаратов. Железа(II) сульфат: 2 Fe. SO 4 + 2 Ce(SO 4)2 Fe 2(SO 4)3 + Ce 2(SO 4)3 С(Ce(SO 4)2)·M(Fe. SO 4) Т(Ce(SO 4)2/Fe. SO 4) = ————— 1000
Кислые растворы Ce(IV) окрашены в желто- оранжевый цвет Кислые растворы Ce(III) бесцветны Ind –» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-40.jpg» alt=»>Кислые растворы Ce(IV) окрашены в желто- оранжевый цвет Кислые растворы Ce(III) бесцветны Ind –» /> Кислые растворы Ce(IV) окрашены в желто- оранжевый цвет Кислые растворы Ce(III) бесцветны Ind – ферроин, о-фенантролин, дифениламин и др.
Кислота аскорбиновая: С(Ce(SO 4)2)·M(1/2 Аск) Т(Ce(SO 4)2/Аск) = ————— » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-41.jpg» alt=»>Кислота аскорбиновая: С(Ce(SO 4)2)·M(1/2 Аск) Т(Ce(SO 4)2/Аск) = ————— » /> Кислота аскорбиновая: С(Ce(SO 4)2)·M(1/2 Аск) Т(Ce(SO 4)2/Аск) = ————— 1000
НИТРИТОМЕТРИЯ Титрант – 0, 1 М или 0, 05 М раствор» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-42.jpg» alt=»> НИТРИТОМЕТРИЯ Титрант – 0, 1 М или 0, 05 М раствор» /> НИТРИТОМЕТРИЯ Титрант – 0, 1 М или 0, 05 М раствор Na. NO 2 + 2 H+ + ē NO + H 2 O М(Na. NO 2) = М(Na. NO 2)/1 Титрант готовят приблизительно нужной концентрации Стандартизация по сульфаниловой кислоте:
С(Слф)пр V(Слф) С(Na. NO 2)пр = » src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-43.jpg» alt=»> С(Слф)пр V(Слф) С(Na. NO 2)пр = » /> С(Слф)пр V(Слф) С(Na. NO 2)пр = V(Na. NO 2) С(Na. NO 2)пр K = С(Na. NO 2)теор
В фарманализе прямая нитритометрия применяется для» src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-44.jpg» alt=»>В фарманализе прямая нитритометрия применяется для» /> В фарманализе прямая нитритометрия применяется для к. . лек. препаратов, содер — о жащих первичную или вторичную аминогруп- п ы , для определения гидразидов , ароматичес — ких нитросоединений после предварительного восстановления нитрогруппы до аминогруп — пы.
Стрептоцид: Соль диазония Ind – внешние (иодидкрахмальная бумага) 2″ src=»http://present5.com/presentation/3/37482110_232718978.pdf-img/37482110_232718978.pdf-45.jpg» alt=»>Стрептоцид: Соль диазония Ind – внешние (иодидкрахмальная бумага) 2″ /> Стрептоцид: Соль диазония Ind – внешние (иодидкрахмальная бумага) 2 KI + 2 HNO 2 + 2 HCl I 2 + 2 NO + 2 KCl + 2 H 2 O внутренние (тропеолин 00 + метиленовый синий, нейтральный красный)
Особенности титрования: * KBr – катализатор * t Особенности титрования: * KBr – катализатор * t Особенности титрования: * KBr – катализатор * t m(Стр) = (VNa. NO 2 оп–VNa. NO 2 к. о. )·K·TNa. NO 2/Стр» /> m(Стр) = (VNa. NO 2 оп–VNa. NO 2 к. о. )·K·TNa. NO 2/Стр (VNa. NO 2 оп–VNa. NO 2 к. о. )·K·TNa. NO 2/Стр· 100 (Стр) = —————————% а(Стр) С(Na. NO 2)·M(Стр) Т(Na. NO 2/Стр) = ————— 1000
источник












