Проекционные формулы Фишера. Относительная D- и L – система стереохимической номенклатуры. Абсолютная конфигурация стереоизомеров.
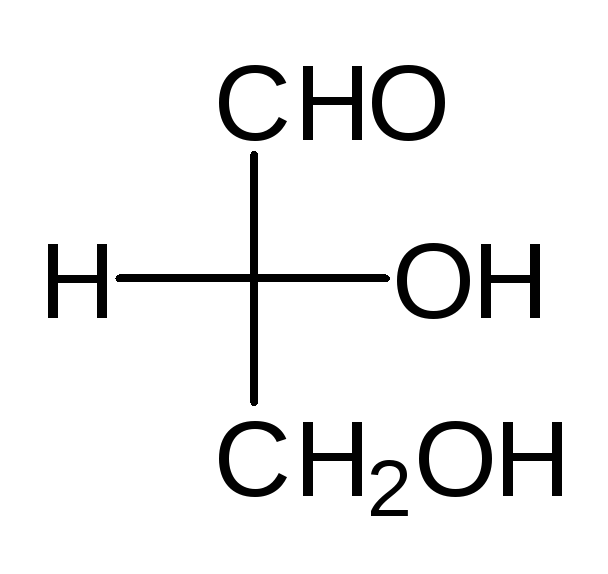
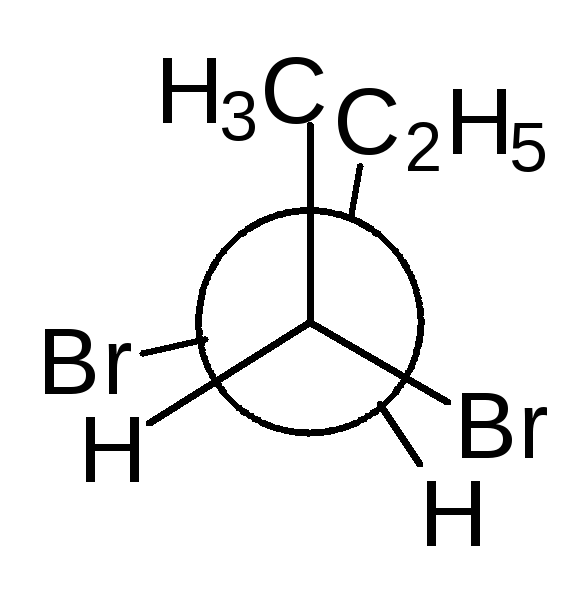
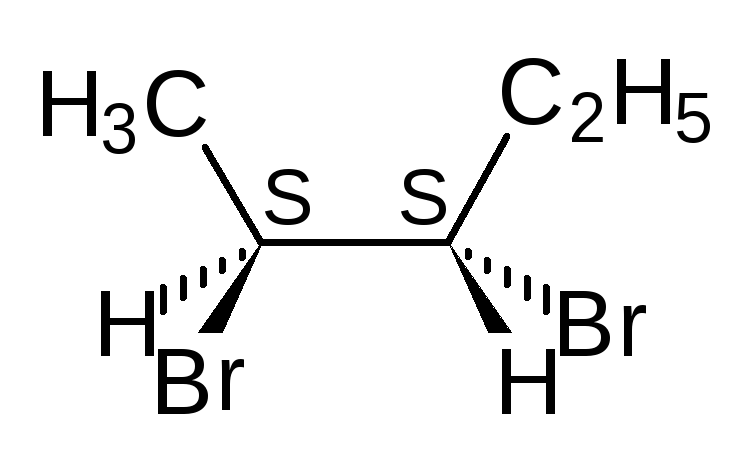
Проекционные формулы Фишера.Рассмотрим их построение на примере молочной (2-гидроксипропановой) кислоты.
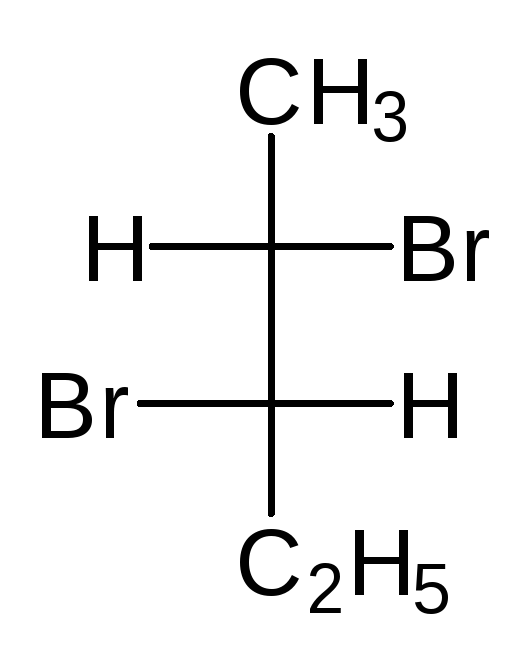
Тетраэдрическую модель одного из энантиомеров (рис. 10) располагают в пространстве так, чтобы цепь атомов углерода оказалась в вертикальном положении, а карбоксильная группа — сверху. Связи с неуглеродными заместителями (Н и ОН) у хирального центра должны быть направлены к наблюдателю.
Рис. 10.Построение проекционной формулы Фишера (+)-молочной кислоты
После этого модель проецируют на плоскость. Символ асимметрического атома при этом опускается, под ним понимают точку пересечения вертикальной и горизонтальной линий.
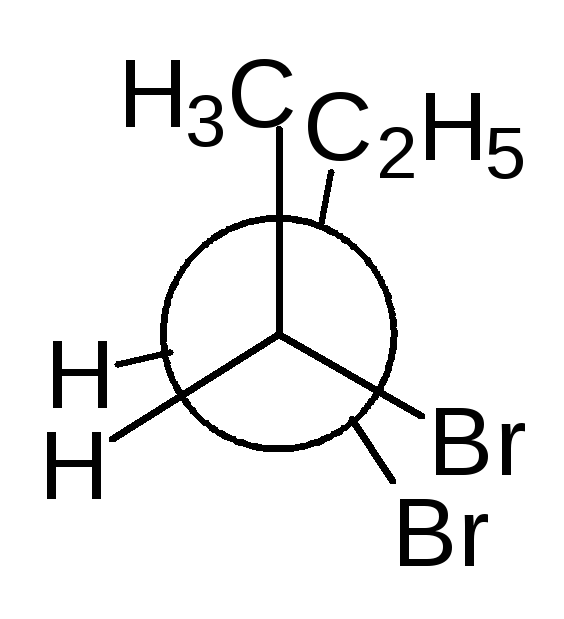
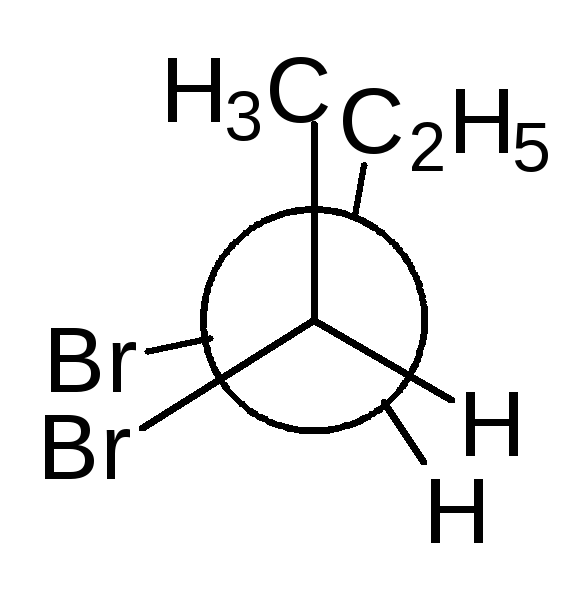
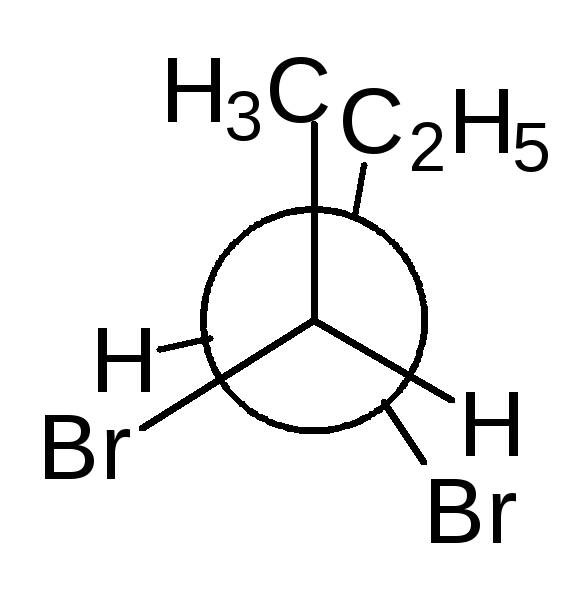
Тетраэдрическую модель хиральной молекулы перед проецированием можно располагать в пространстве по-разному, не только так, как показано на рис. 7. Необходимо только, чтобы связи, образующие на проекции горизонтальную линию, были направлены к наблюдателю, а вертикальные связи — за плоскость рисунка.
Полученные таким образом проекции можно с помощью несложных преобразований привести к стандартному виду, в котором углеродная цепь расположена вертикально, а старшая группа (в молочной кислоте это СООН) — сверху. Преобразования разрешают две операции:
• в проекционной формуле разрешается менять местами два любых заместителя у одного и того же хирального центра четное число раз (двух перестановок бывает достаточно);
• проекционную формулу разрешается поворачивать в плоскости рисунка на 180° (что эквивалентно двум перестановкам), но не на 90°.
Тетраэдрическую модель строения органических соединений предложили Я.Г.Вант-Гофф и Ж.А.Ле-Бель в 1874 г. Они пришли к выводу, что если две молекулы являются стереоизомерами, то их можно описать зеркальными формулами, и если один изомер вращает плоскость поляризации влево, то второй должен вращать вправо. По знаку вращения можно определить относительную конфигурацию стереоизомеров. Однако между абсолютной конфигурацией, т.е. истинным расположением групп вокруг данного хирального центра, и знаком вращения прямого соответствия нет. Определить абсолютную конфигурацию химическими методами, если не известна абсолютная конфигурация хотя бы одного хирального реагента (а так и было вначале), невозможно. Спектральные методы могут дать информацию только об относительной конфигурации. В настоящее время существуют лишь два метода независимого определения абсолютной конфигурации: теоретический расчет и исследование аномальной дифракции рентгеновских лучей на ядрах тяжелых элементов.
Но в конце XIX — начале XX века этих методов не существовало и поэтому химики придумали следующий выход. Решили взять в качестве стандарта какое-нибудь одно соединение и произвольно приписать ему одну из возможных абсолютных конфигураций. Выбор пал на глицериновый альдегид по той причине, что он структурно связан с сахарами, которые в то время изучал Эмиль Фишер. (+) — Изомеру была приписана абсолютная конфигурация и он был обозначен буквой D (dextriogyrus — правый), а соответствующий (-) — изомер — буквой L (laevogyrus — левый). Как только был выбран стандарт, стало возможным соотносить с ним конфигурацию других соединений. Например, при окислении с помощью HgO (+)-глицериновый альдегид дает (-)-глицериновую кислоту. Данная реакция не затрагивает асимметричский атом, поэтому очень мало вероятно, чтобы его конфигурация изменилась, и следовательно (-)-глицериновая кислота относится к D — ряду.
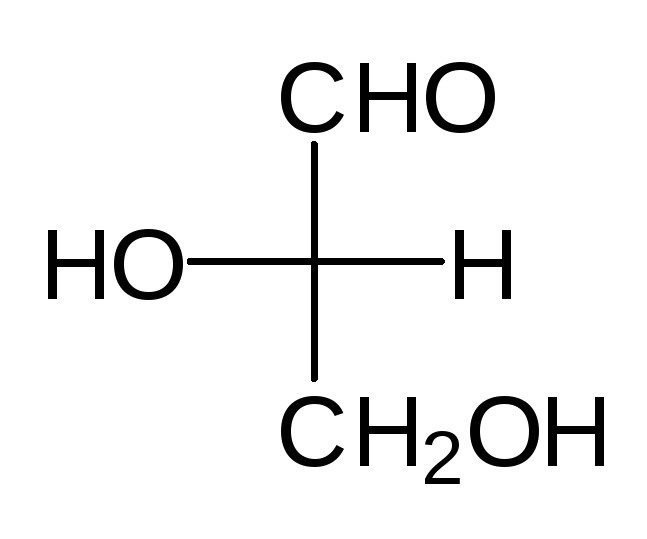
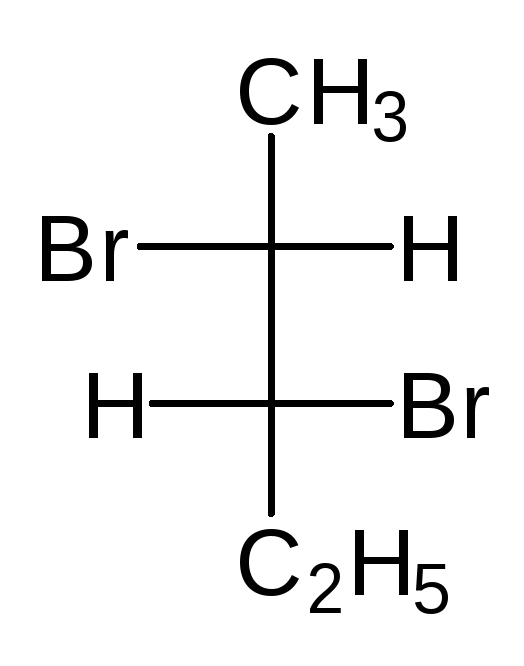
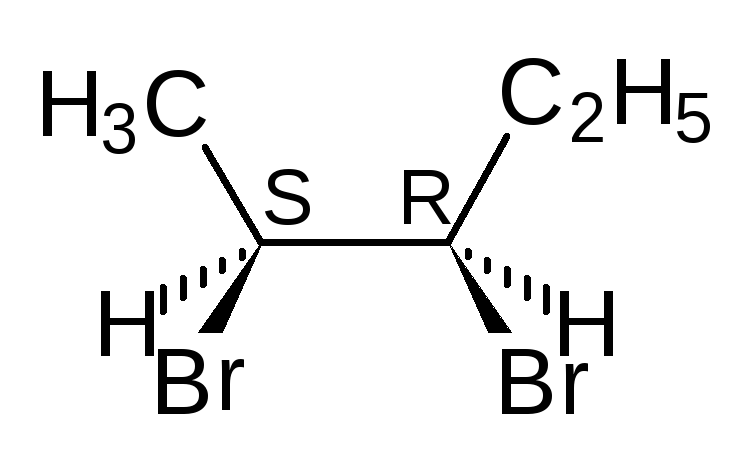
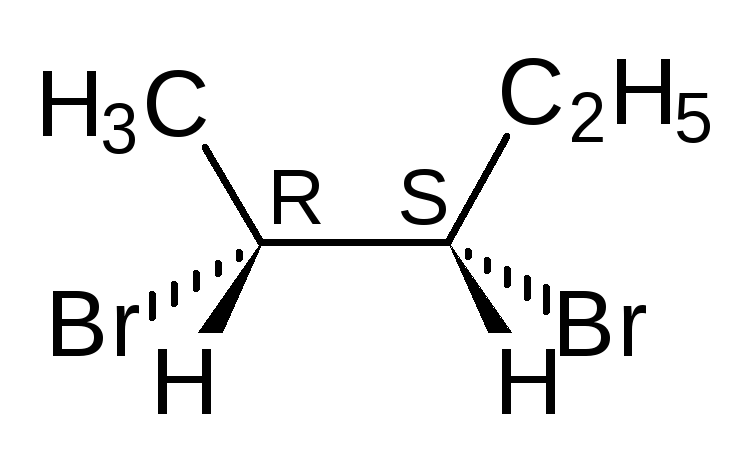
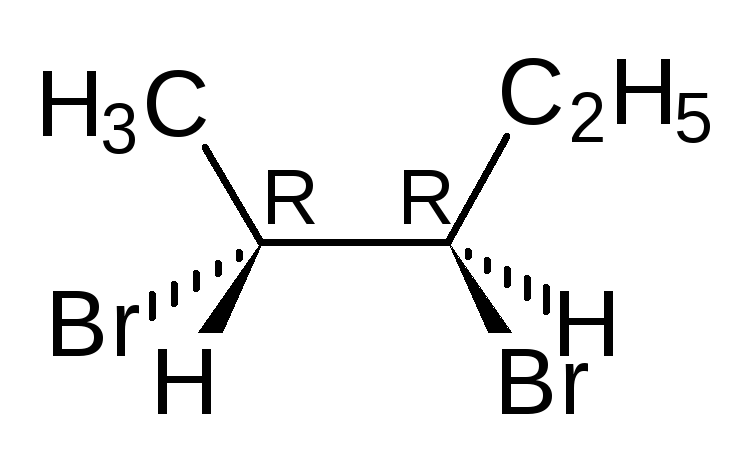
Отнесение к D- или L-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией D- или L-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у L-глицеринового альдегида, поэтому энантиомер (I) относят к L-ряду. Из тех же соображений энантиомер (II) относят к D-ряду. Так из сравнения проекций Фишера определяют относительнуюконфигурацию.
Следует отметить, что L-глицериновый альдегид имеет левое вращение, а L-молочная кислота — правое (и это не единичный случай). Более того, одно и то же вещество может быть как лево-, так и правовращающим в зависимости от условий определения (разные растворители, температура).
источник
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но разное строение, а поэтому – разные свойства. Изомеры делят на два типа – структурные и стереоизомеры.
Структурные изомеры имеют разное химическое строение (отличаются последовательностью соединения атомов в молекулах). Структурная изомерия обусловлена:
изомерией углеродного скелета:
изомерией положения кратных связей или функциональных групп:
Разновидностью межклассовой изомерии является таутомерия. Таутомерия – подвижная динамическая изомерия, обусловленная переносом протона (или другой подвижной частицы) и сопровождающаяся миграцией двойной связи.
Стереоизомеры имеют одинаковое химическое строение, но отличаются расположением атомов или групп атомов в пространстве. Причиной различного пространственного расположения атомов и групп атомов в молекулах стереоизомеров являются отличия в конфигурации или конформации молекул.
Конфигурация – это определенное пространственное расположение атомов в молекуле без учета вращения вокруг одной или нескольких s-связей.
Конформация – это определенное пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких s-связей.
И конфигурационные, и конформационные стереоизомеры делятся на энантиомеры (оптические изомеры) и диастереомеры (геометрические). Энантиомеры (оптические изомеры, оптические антиподы) – это стереоизомеры, соотносящиеся между собой как предмет и несовместимое с ним зеркальное отображение.
Оптическая изомерия характерна для молекул, не имеющих элементов симметрии – плоскости симметрии, центра симметрии, оси симметрии второго и высших порядков. Плоскость симметрии – воображаемая плоскость, делящая фигуру (молекулу) на две равные части. Ось симметрии – это проходящая через фигуру ось, при вращении вокруг которой на 360° фигура совмещается. Если при вращении вокруг оси симметрии на 360° происходит совмещение 1 раз, то говорят, что фигура имеет ось симметрии 1-го порядка, если два раза, – ось симметрии 2-го порядка и т.д. Центр симметрии – точка пересечения осей симметрии. Самой симметричной фигурой является шар, имеющий центр симметрии и бесчисленное множество плоскостей и осей симметрии. Самым асимметричным телом является рука.
Энантиомеры обладают практически одинаковыми физическими и химическими свойствами, но отличаются по оптической активности и реакционной способности в отношении хиральных реагентов. Диастереомеры – это стереоизомеры, не являющиеся зеркальными отображениями друг друга. Они обладают разными физическими и химическими свойствами.
Конфигурационные изомеры можно рассмотреть на примерах молекул бутанола-2 и бутена-2. Все атомы углерода в молекуле бутанола-2 находятся в тетраэдрической конфигурации (вследствие sр 3 -гибридизации атомных орбиталей углерода все четыре s-связи каждого атома углерода направлены к вершинам тетраэдра), однако заместители, связанные со вторым атомом углерода, могут по-разному располагаться в вершинах тетраэдра, что ведет к существованию для этой молекулы двух стереоизомеров. Стереоизомеры бутанола-2 соотносятся между собой как предмет и несовместимое с ним зеркальное отображение и являются энантиомерами.
В молекуле бутена-2 атомы углерода, образующие двойную связь, имеют тригональную конфигурацию (вследствие sр 2 -гибридизации атомных орбиталей углерода три s-связи расположены в одной плоскости под углом 120°, а негибридная р-орбиталь расположена перпендикулярно этой плоскости). Конфигурационные изомеры в этом примере возникают из-за разного расположения заместителей относительно двойной связи. Стереоизомеры бутена-2 не являются зеркальными отображениями друг друга и являются диастереомерами (p-диастереормерами).
Конформационные изомеры (конформеры) известны практически для любых органических соединений, в молекулах которых возможно вращение относительно связи углерод-углерод или углерод-гетероатом. Из приведенных ниже примеров видно, что такие стереоизомеры не являются зеркальными отображениями друг друга и поэтому являются диастереомерами.
Энергии различных конформаций неодинаковы, поэтому неодинакова и вероятность нахождения молекулы в той или иной конформации. Если затраты энергии для перехода из одной конформации в другую невелики, то соединение существует в виде равновесной смеси разных конформеров. Если одна конформация более выгодна энергетически, то молекула преимущественно существует в виде этого конформера (как правило, при низких температурах), в отдельных случаях конформеры можно выделить в индивидуальном виде.
Под оптической активностью понимают способность некоторых веществ вращать плоскость плоскополяризованного света по часовой стрелке или против часовой стрелки на одинаковый угол. Оптическая активность возникает в случае, когда молекула не может быть совмещена со своим зеркальным отображением.
Молекулы, которые не совместимы со своим зеркальным отображением, называются хиральными; те молекулы, которые можно совместить со своим зеркальным отображением, называются ахиральными. Хиральная молекула и ее зеркальное отображение – разные соединения, являющиеся стереоизомерами – энантиомерами (оптическими антиподами).
Хиральные молекулы не имеют плоскости симметрии, центра симметрии, оси симметрии 2-го и более высоких порядков. Простейший случай хиральной структуры – это «асимметрически замещенный атом углерода», т.е. атом углерода, связанный с четырьмя разными заместителями. Так, молекула бутанола-2 имеет асимметрический атом углерода (хиральный центр) и является хиральной, существует в виде двух энантиомеров.
Если в молекуле есть два одинаковых заместителя у одного атома углерода, как в молекуле пропанола-2, то в молекуле появляется плоскость симметрии, и такая молекула совместима со своим зеркальным отображением. В качестве хирального центра могут выступать и другие атомы – Si, N, Р. Наличие в молекуле асимметрически замещенного атома является необходимым, но не всегда достаточным условием для проявления хиральности. Главным условием является отсутствие в молекуле элементов симметрии, тогда хиральной может быть молекула, не имеющая хирального центра. Примером такой хиральной молекулы может служить пентадиен-2,3.
Метильные группы располагаются во взаимно перпендикулярных плоскостях, что делает молекулу пентадиена-2,3 асимметричной в целом. В то же время молекула пропадиена (аллен) имеет плоскость симметрии и поэтому является ахиральной. Хотя трехмерные формулы достаточно хорошо отражают структуру хиральных молекул, они неудобны и громоздки для отображения молекул, содержащих несколько хиральных центров. Для изображения энантиомеров на плоскости (для записи) используют проекционные формулы Фишера.
На плоскость проецируется тетраэдр, расположенный таким образом, чтобы вверху оказалась наиболее окисленная группа (СООН, СНО, SO3H и др.), а на горизонтальном ребре, повернутом к наблюдателю, располагались атом водорода и функциональная группа (ОН, NH2, Br, I, Fи др). Хиральный центр изображается на плоскости как пересечение вертикальной и горизонтальных линий. На горизонтальной линии располагаются заместители, направленные к наблюдателю (расположенные на горизонтальном ребре тетраэдра), а на вертикальной – заместители, удаленные от наблюдателя (находящиеся за плоскостью бумаги). Проекционные формулы Фишера для 2-аминопропановой кислоты и глицеринового альдегида имеют вид:
При использовании проекционных формул Фишера необходимо учитывать следующие правила:
— поворот проекционной формулы на 180° в плоскости бумаги не меняет стереохимического смысла;
— четное число перестановок заместителей у хирального центра не меняет стереохимического смысла;
— повороты проекционной формулы Фишера в плоскости бумаги на 90° или 270°, а также поворот на 180° с выводом из плоскости дают проекцию энантиомера, т.е. меняют стереохимический смысл на противоположный;
— нечетное число перестановок заместителей у хирального центра дает проекцию энантиомера, т.е. меняет стереохимический смысл на противоположный.
Определение истинного пространственного расположения атомов в молекуле, т.е. абсолютной конфигурации, стало возможным с использованием рентгеноструктурного анализа. В качестве конфигурационного стандарта был принят глицериновый альдегид. Правовращающий энантиомер глицеринового альдегида назвали D-(+)-глицериновый альдегид, левовращающий энантиомер назвали L-(-)-глицериновый альдегид.
В этих названиях символы D и L обозначают только конфигурацию и не имеют связи с оптическим вращением. Одно и то же соединение в зависимости от условий определения оптической активности может быть как правовращающим (+), так и левовращающим (-). Буквы D и L – символы стереохимической номенклатуры. К D-ряду относятся родственные глицериновому альдегиду соединения, в проекционных формулах Фишера которых функциональные группы, связанные с хиральным центром, расположены справа от вертикальной линии, к L-ряду – слева.
D- и L-глицериновый альдегид используется для определения конфигурации оптически активных молекул. Определение конфигурации проводят путем сравнения конфигурации исследуемой молекулы с абсолютной конфигурацией соединения, принятого за стандарт, т.е с конфигурацией D- или L- глицеринового альдегида. Сравнение конфигурации исследуемых соединений с конфигурационным стандартом (т.е. определение относительной конфигурации) проводят путем ряда химических превращений, не затрагивающих хиральный центр. Так, если нужно определить конфигурацию хирального центра оптически активной молекулы 2-гидрокси-3-хлорпропановой кислоты, можно поступить следующим образом:
Провести гидролиз исследуемого соединения до глицериновой кислоты:
В этом случае хиральный центр не участвует в реакции, его конфигурация не меняется.
Провести окисление D- и L- глицериновых альдегидов до соответствующих D- и L-глицериновых кислот:
В этих превращениях хиральные центры не участвуют в реакции, их конфигурация не меняется.
Сравнить оптическую активность (угол вращения и знак) глицериновой кислоты, полученной из исследуемого соединения, и оптическую активность D- и L–глицериновых кислот. Если оптическая активность глицериновой кислоты, полученной из исследуемого соединения, совпадает с оптической активностью D-глицериновой кислоты, полученной из D-глицеринового альдегида, значит, исследуемое соединение принадлежит к D- ряду. Если оптическая активность глицериновой кислоты, полученной из исследуемого соединения, совпадает с оптической активностью L-глицериновой кислоты, полученной из L-глицеринового альдегида, значит, исследуемое соединение принадлежит к L- ряду.
Хотя D/L система стереохимической номенклатуры используется часто, особенно в химии углеводов и аминокислот, Кан, Ингольд и Прелог предложили более универсальную R/S систему отнесения конфигурации оптических изомеров. Система основана на «старшинстве» заместителей. Заместители, расположенные в вершинах тетраэдра, получают номера от 1 до 4, 1 – самый старший.
Тетраэдр располагают таким образом, чтобы младший заместитель (обычно атом Н) был наиболее удаленным от наблюдателя. Если старшинство трех других заместителей, расположенных в основании тетраэдра, повернутого к наблюдателю, убывает по часовой стрелке, то такую конфигурацию обозначают буквой R, если старшинство заместителей убывает против часовой стрелки, тогда конфигурация хирального центра обозначается буквой S. Порядок старшинства определяется специальными правилами, которые здесь рассматриваться не будут.
Многие органические молекулы имеют в своем составе несколько хиральных центров, что приводит к увеличению количества стереоизомеров. Число стереоизомеров N можно найти по формуле N = 2 n , где n – число хиральных центров в молекуле. В молекуле 2-бром-3-гидроксибутандиовой кислоты имеется два хиральных центра,
вследствие чего соединение имеет две пары энантиомеров, а общее число стереоизомеров равно 4. Соединение из первой пары энантиомеров по отношению к любому соединению из второй пары энантиомеров является диастереомером.
Понятия энантиомерии и диастереомерии взаимоисключающие, т.е. если два стереоизомера не являются энантиомерами друг по отношению к другу, то они диастереомеры. Принадлежность к D-,L-рядам стереохимической номенклатуры определяется с помощью «гидроксикислотного ключа», который учитывает конфигурацию ближайшего к карбоксильной группе хирального центра.
Известны соединения, в которых количество стереоизомеров на практике оказывается меньше рассчитанного из формулы N = 2 n :
Для винной кислоты известны три стереоизомера: пара энантиомеров (D-винная и L-винная кислоты) и мезовинная кислота, не обладающая оптической активностью. Отсутствие оптической активности у мезовинной кислоты и невозможность ее существования в виде пары энантиомеров объясняется наличием в ее молекуле плоскости симметрии. Мезовинная кислота по отношению к D- или L-винным кислотам является диастереомером.
Смесь равных количеств энантиомеров называется рацематом. Рацемат оптической активностью не обладает. Оптическая активность будет проявляться лишь в случае, когда рацемическая смесь состоит из разных количеств энантиомеров. Для разделения рацематов на энатиомеры используют четыре способа: механический, биохимический (ферментативный), химический и адсорбционный.
Механический способ является исторически первым методом разделения энантиомеров. Он основан на разделении энантиомеров по форме кристаллов, образующихся при кристаллизации рацемата (энантиомеры кристаллизуются независимо друг от друга, их кристаллы являются зеркальными отображениями друг друга).
Ферментативный способ основан на том, что микроорганизмы могут потреблять один из энантиомеров. В этом случае теряется один из энантиомеров.
Химический способ основан на переводе энантиомеров под действием хирального реагента в смесь диастереомеров, имеющих существенные различия в физических и химических свойствах, и последующее их разделение.
Адсорбционный (хроматографический) метод основывается на:
— использовании различной адсорбционной способности диастереомеров, в этом случае их разделение возможно на обычных адсорбентах;
— непосредственном разделении энантиомеров на оптически активных адсорбентах.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 8181 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Переход от простейшего органического углеводорода — метана, к его ближайшему гомологу — этану ставит проблемы пространственного строения, для решения которых недостаточно знать рассмотренные в разделе параметры. В самом деле, не меняя ни валентных углов, ни длин связей, можно представить себе множество геометрических форм молекулы этана, отличающихся друг от друга взаимным поворотом углеродных тетраэдров вокруг соединяющей их связи С-С. В результате такого вращения возникают поворотные изомеры (конформеры). Энергия различных конформеров неодинакова, но энергетический барьер, разделяющий различные поворотные изомеры, для большинства органических соединений невелик. Поэтому при обычных условиях, как правило, нельзя зафиксировать молекулы в одной строго определенной конформации: обычно в равновесии сосуществуют несколько легко переходящих друг в друга поворотных форм.
Способы графического изображения конформаций и их номенклатура таковы. Рассмотрение начнем с молекулы этана. Для нее можно предвидеть существоввание двух максимально различающихся по энергии конформаций. Они изображены ниже в виде перспективных проекций (1) («лесопильные козлы»), боковых проекций (2) и формул Ньюмена (3).
В перспективной проекции (1а, 1б) связь С-С надо представить себе уходящей вдаль; стоящий слева углеродный атом приближен к наблюдателю, стоящий справа — удален от него.
В боковой проекции (2а, 2б) четыре Н-атома лежат в плоскости чертежа; атомы углерода на самом деле несколько выходят из этой плоскости, но обычно упрощенно считают их также лежащими в плоскости чертежа. «Жирные» клиновидные связи утолщением клина показывают на выход из плоскости по направлению к наблюдателю того атома, к которому обращено утолщение. Пунктирные клиновидные связи отмечают удаление от наблюдателя.
В проекции Ньюмена (3а, 3б) молекулу рассматривают вдоль связи С-С (в направлении, указанном стрелкой на формулах 1а,б). Три линии, расходящиеся под углом 120 о из центра круга, обозначают связи ближайшего к наблюдателю углеродного атома; линии, «высовывающиеся» из-за круга — связи удаленного углеродного атома.
Изображенную слева конформацию называют заслоненной: название это напоминает о том, что атомы водорода обеих СН3-групп находятся друг против друга. Заслоненная конформация имеет повышенную внутреннюю энергию, и поэтому невыгодна. Конформацию, изображенную справа, называют заторможенной, подразумевая, что свободное вращение вокруг связи С-С «тормозится» в этом положении, т.е. молекула существует преимущественно в этой конформации.
Минимум энергии, необходимый для полного вращения молекулы вокруг определенной связи называется барьером вращения для данной связи. Барьер вращения в молекуле, подобной этану, может быть выражен через изменение потенциальной энергии молекулы как функции изменения двугранного (торсионного) угла системы. Двугранный угол (обозначаемый тау ) изображен на рисунке, приведенном ниже:
Энергетический профиль вращения вокруг связи С-С в этане показан на следующем рисунке. Вращение «заднего» атома углерода изображено изменением двугранного угла между двумя показанными атомами водорода. Для простоты остальные атомы водорода опущены. Барьер вращения, разделяющий две формы этана, составляет только 3 ккал/моль (12.6 кДж/моль). Минимумы кривой потенциальной энергии соответствуют заторможенным конформациям, максимумы — заслоненным. Поскольку при комнатной температуре энергия некоторых столкновений молекул может достигать 20 ккал/моль (около 80 кДж/моль), то этот барьер в 12.6 кДж/моль легко преодолевается и вращение в этане рассматривают как свободное.
Подчеркнем, что каждая точка на кривой потенциальной энергии соответствует определенной конформации. Точки, соответствующие минимумам, отвечают конформационным изомерам, то есть преобладающим компонентам в смеси всех возможных конформаций.
С усложнением молекулы число возможных заметно отличающихся по энергии конформаций возрастает. Так, для н-бутана можно изобразить уже шесть конформаций, отличающихся взаимным расположением СН3-групп, т.е. поворотом вокруг центральной связи С-С. Ниже конформации н-бутана изображены в виде проекций Ньюмена. Изображенные слева (заслоненные) конформации энергетически невыгодны, практически реализуются лишь заторможенные.
Различные заслоненные и заторможенные конформации бутана неодинаковы по энергии. Соответствующие энергии всех конформаций, обрпзующихся при вращении вокруг центральной С-С связи, представлены ниже:
По мере усложнения молекулы число возможных конфомаций возрастает.
Итак, конформации — это различные неидентичные пространственные формы молекулы, имеющие определенную конфигурацию. Конформеры — это стереоизомерные структуры, находящиеся в подвижном равновесии и способные к взаимопревращению путем вращения вокруг простых связей.
Иногда барьер таких превращений становится достаточно высоким, чтобы разделить стереоизомерные формы (пример — оптически активные дифенилы; см. раздел II.9). В таких случаях говорят уже не о конформерах, а о реально существующих стереоизомерах.
Важное следствие жесткости двойной связи (отсутствия вращения вокруг нее) — существование геометрических изомеров. Самые распространенные из них — это цис-транс-изомеры соединений этиленового ряда, содержащих у ненасыщенных атомов неодинаковые заместители. Простейшим примером могут служить изомеры бутена-2.
| цис-Бутен-2 | транс-Бутен-2 |
| Т.пл. -138.9 о С | -105.6 о С |
| Т.кип. 3.72 о С | 1.0 о С |
| 0.604 | |
| nD -20 1.3946 | 1.3862 |
Геометрические изомеры имеют одинаковое химическое строение (одинаковый порядок химической связи), различаясь по пространственному расположению атомов, по конфигурации. Это различие и создает разницу в физических (а также химических свойствах). Геометрические изомеры, в отличие от конформеров, могут быть выделены в чистом виде и существуют как индивидуальные, устойчивые вещества. Для их взаимного превращения необходима обычно энергия порядка 125-170 кДж/моль (30-40 ккал/моль). Эту энергию можно сообщить нагреванием или облучением.
В простейших случаях номенклатура геометрических изомеров не представляет затруднений: цис-формами называют геометрические изомеры, у которых одинаковые заместители лежат по одну сторону от плоскости пи-связи, транс-изомеры имеют одинаковые заместители на разных сторонах от плоскости пи-связи. В более сложных случаях применяется Z,E-номенклатура. Ее главный принцип: для обозначения конфигурации указывают цис- (Z, от немецкого Zusammen — вместе) или транс- (Е, от немецкого Entgegen — напротив) расположение старших заместителей при двойной связи.
В Z,E-системе старшими считаются заместители с большим атомным номером. Если атомы, непосредственно связанные с ненасыщенными углеродами, одинаковы, то переходят ко «второму слою», в случае необходимости — к «третьему слою» и т.д.
Рассмотрим применение правил Z,E-номенклатуры на двух примерах.
Начнем с формулы I, где все решается атомами «первого слоя». Расставив их атомные номера, получим, что старшие заместители каждой пары (бром в верхней части формулы и азот в нижней) находятся в транс-положении, отсюда следует стереохимические обозначение Е:
Е-1-бром-1-хлор-2-нитроэтен
Для определения стереохимического обозначения структуры II необходимо искать различие в «высших слоях». По первому слою группы СН3, С2Н5, С3Н7 не отличаются. Во втором слое у группы СН3 сумма атомных номеров равна трем (три атома водорода), у групп С2Н5 и С3Н7 — по 8. Значит, группа СН3 не рассматривается — она младше двух других. Таким образом, старшие группы — это С2Н5 и С3Н7, он находятся в цис-положении; стереохимические обозначение Z.
Z-3-метилгептен-3
Если бы понадобилось определить, какая группа старше — С2Н5 или С3Н7, пришлось бы перейти к атомам «третьего слоя», сумма атомных номеров в этом слое для обеих групп оказались бы соответственно равными 3 и 8, т.е. С3Н7 старше, чем С2Н5. В более сложных случаях определения старшинства надо учитывать дополнительные условия, как-то: атом, связанный двойной связью, считается дважды, связанный тройной — трижды; из числа изотопов старше более тяжелый (дейтерий старше водорода) и некоторые другие.
Отметим, что обозначения Z не является синонимами цис-обозначений, как и обозначения Е не всегда соответствуют расположению транс-, например:
1. Бомбикол — феромон (половой аттрактант) тутового шелкопряда — представляет собой E-10-Z-12-гексадекадиенол-1. Изобразите его структурную формулу.
2. Назовите по Z,E-номенклатуре следующие соединения:
Среди органических соединений встречаются вещества, способные вращать плоскость поляризаации света. Это явление называют оптической активностью, а соответствующие вещества — оптически активными. Оптически активные вещества встречаются в виде пар оптических антиподов — изомеров, физические и химические свойства которых в обычных условиях одинаковы, за исключением одного — знака вращения плоскости поляризации. (Если один из оптических антиподов имеет, например, удельное вращение [ПРИМ.1] +20 о , то другой — удельное вращение -20 о ).
Оптическая изомерия появляется тогда, когда в молекуле присутствуетасимметрический атом углерода [ПРИМ.2]; так называют атом углерода, связанный с четырьмя различными заместителями. Возможны два тетраэдрических расположения заместителей вокруг асимметрического атома. Обе пространственные формы нельзя совместить никаким вращением; одна из них является зеркальным изображением другой:
Для условного изображения асимметрического атома на плоскости пользуются проекционными формулами Э.Фишера. Их получают, проецируя на плоскость атомы, с которыми связан асимметрический атом. При этом сам асимметрический атом, как правило, опускают, сохраняя лишь перекрещивающиеся линии и символы заместителей. Чтобы помнить о пространственном расположении заместителей, часто сохраняют в проекционных формулах прерывистую вертикальную линию (верхний и нижний заместитель удалены за плоскость чертежа), однако часто этого не делают. Ниже приведены различные способы записи проекционной формулы, отвечающей левой модели на предыдущем рисунке:
Приведем несколько примеров проекционных формул:
(+)-аланин (-)-бутанол (+)-глицериновый альдегид
При названиях веществ приведены их знаки вращения: это значит, например, что левовращающий антипод бутанола-2 имеет пространственную конфигурацию, выражаемую именно приведенной выше формулой, а ее зеркальное изображение отвечает правовращающему бутанолу-2. Определение конфигурации оптических антиподов проводится экспериментально [ПРИМ.3].
В принципе, каждый оптический антипод может быть изображен двенадцатью (!) различными проекционными формулами — в зависимости от того, как расположена модель при проекции, с какой стороны мы смотрим на нее. Чтобы стандартизировать проекционные формулы, введены определенные правила их написания. Так, главную функцию, если она стоит в конце цепи, принято ставить наверху, главную цепь изображать вертикально.
Для того, чтобы сопоставлять «нестандартно» написанные проекционные формулы, надо знать следующие правила преобразования проекционных формул.
1. Формулы можно вращать в плоскости чертежа на 180 о , не меняя их стереохимического смысла:
2. Две (или любое четное число) перестановки заместителей у одного асимметрического атома не меняют стереохимического смысла формулы:
3. Одна (или любое нечетное число) перестановок заместителей у асимметрического центра приводит к формуле оптического антипода:
4. Поворот в плоскости чертежа на 90 о превращает формулу в антиподную, если только при этом одновременно не изменить условие расположения заместителей относительно плоскости чертежа, т.е. не считать, что теперь боковые заместители находятся за плоскостью чертежа, а верхний и нижний — перед ней. Если пользоваться формулой с пунктиром, то изменившаяся ориентация пунктира прямо напомнит об этом:
5. Вместо перестановок проекционные формулы можно преобразовывать путем вращения любых трех заместителей по часовой стрелке или против нее; четвертый заместитель при этом положения не меняет (такая операция эквивалентна двум перестановкам):
6. Проекционные формулы нельзя выводить из плоскости чертежа (т.е. нельзя, например, рассматривать их «на просвет» с обратной стороны бумаги — при этом стереохимический смысл формулы изменится).
Если в формуле вещества есть асимметрический атом, это отнюдь не означает, что такое вещество будет обладать оптической активностью. Если асимметрический центр возникает в ходе обычной реакции (замещение в группе СН2, присоединение по двойной связи и т.п.), то вероятность создания обеих антиподных конфигураций одинакова. Поэтому, несмотря на асимметрию каждой отдельной молекулы, получающееся вещество оказывается оптически неактивным. Такого рода оптически неактивные модификации, состоящие из равного количества обоих антиподов, называются рацематами [ПРИМ.4].
Соединения с несколькими асимметрическими атомами обладают важными особенностями, отличающими их от рассмотренных ранее более простых оптически активных веществ с одним центром асимметрии.
Допустим, что в молекуле некоего вещества имеются два асимметрических атома; обозначим их условно А и Б. Легко видеть, что возможны молекулы со следующими комбинациями:
Молекулы 1 и 2 представляют собой пару оптических антиподов; то же самое относится и к паре молекул 3 и 4. Если же сравнивать друг с другом молекулы из разных пар антиподов — 1 и 3, 1 и 4, 2 и 3, 2 и 4, то мы увидим, что перечисленные пары не являются оптическими антиподами: конфигурация одного асимметрического атома у них совпадает, конфигурация другого — не совпадает. Все это пары диастереомеров, т.е. пространственных изомеров, не составляющих друг с другом оптических антиподов.
Диастереомеры отличаются друг от друга не только оптическим вращением, но и всеми другими физическими константами: у них разные температуры плавления и кипения, разные растворимости и др. Различия в свойствах диастереомеров зачастую ничуть не меньше, чем различия в свойствах между структурными изомерами.
Примером соединения рассматриваемого типа может случить хлоряблочная кислота
Ее стереоизомерные формы имеют следующие проекционные формулы:
Названия эритро— и трео— происходят от названий углеводов эритрозы и треозы. Эти названия употребляют для указания взаимного положения заместителей у соединений с двумя асимметрическими атомами: эритро-изомерами называют те, у которых два одинаковых боковых заместителя стоят в стандартной проекционной формуле на одной стороне (справа или слева); трео-изомеры имеют одинаковые боковые заместители на разных сторонах проекционной формулы [ПРИМ.5].
Два эритро-изомера представляют собой пару оптических антиподов, при их смешении образуется рацемат. Парой оптических изомеров являются и трео-формы; они тоже дают при смешении рацемат, отличающийся по свойствам от рацемата эритро-формы. Таким образом, всего существуют четыре оптически активных изомера хлоряблочной кислоты и два рацемата.
При дальнейшем росте числа асимметрических центров число пространственных изомеров возрастает, причем каждый новый асимметрический центр вдвое увеличивает число изомеров. Оно определяется формулой 2 n , где n — число асимметрических центров.
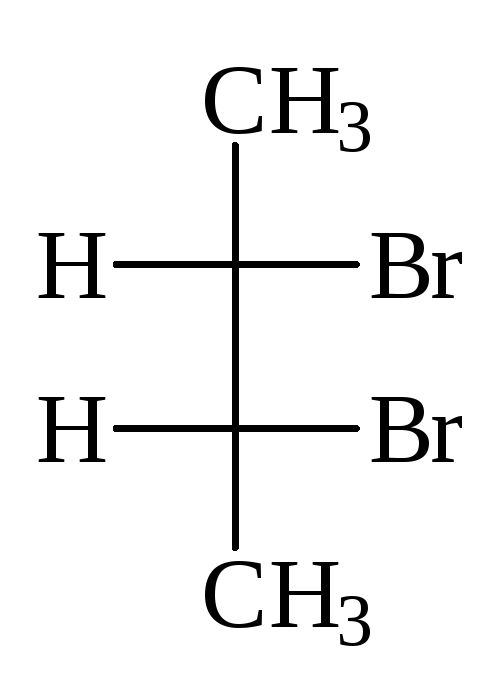
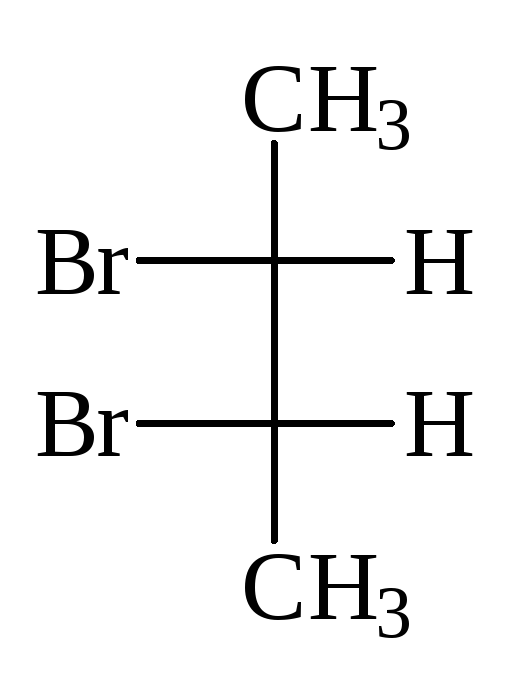
Число стереоизомеров может уменьшаться из-за частичной симметрии, появляющейся в некоторых структурах. Примером может служить винная кислота, у которой число индивидуальных стереоизомеров сокращается до трех. Их проекционные формулы:
Формула I идентична с формулой Iа: превращается в нее при повороте на 180 о в плоскости чертежа и, следовательно, не изображает нового стереоизомера. Это оптически неактивная модификация — мезо-форма. В отличие от рацемата, который может быть расщеплен на оптические антиподы, мезо-форма принципиально нерасщепляема: каждая ее молекула имеет один асимметрический центр одной конфигурациии, второй — противоположной. В итоге происходит внутримолекулярная компенсация вращения обоих асимметрических центров.
Мезо-формы имеются у всех оптически активных веществ с несколькими одинаковыми (т.е. связанными с одинаковыми заместителями) асимметрическими центрами [ПРИМ.6]. Проекционные формулы мезо-форм всегда можно узнать по тому, что их всегда можно разделить горизонтальной линией на две половины, которые по записи на бумаге формально идентичны, в действительности же зеркальны:
Формулы II и III изображают оптические антиподы винной кислоты; при их смешении образуется оптически неактивный рацемат — виноградная кислота.
Самая простая, наиболее старая, однако и ныне еще употребляемая система номенклатуры оптических антиподов основана на сравнении проекционной формулы называемого антипода с проекционной формулой некоего стандартного вещества, выбранного в качестве «ключа». Так, для альфа-оксикислот и альфа -аминокислот ключом является верхняя часть их проекционной формулы (в стандартной записи):
L-оксикислоты (Х = ОН) D-оксикислоты (Х = ОН)
Конфигурацию всех альфа -оксикислот, имеющих в стандартно написанной проекционной формуле Фишера гидроксильную группу слева, обозначают знаком L; если же гидроксил расположен в проекционной формуле справа — знаком D [ПРИМ.7].
Ключом для обозначения конфигурации сахаров служит глицериновый альдегид:
L-(-)-глицериновый альдегид D-(+)-глицериновый альдегид
В молекулах сахаров обозначение D- или L- относится к конфигурации нижнего асимметрического центра.
Система D-,L-обозначений имеет существенные недостатки: во-первых, обозначение D- или L- указывает конфигурацию только одного асимметрического атома, во-вторых, для некоторых соединений получаются разные обозначения, в зависимости от того, взят ли в качестве ключа глицериновый альдегид или оксикислотный ключ, например:
Эти недостатки системы ключей ограничивают ее применение в настоящее время тремя классами оптически активных веществ: сахарами, аминокислотами и оксикислотами. На общее же применение рассчитана «R,S-система Кана, Ингольда и Прелога [ПРИМ.8].
Для определения R- или S-конфигурации оптического антипода необходимо расположить тетраэдр заместителей вокруг асимметрического углеродного атома таким образом, чтобы младший заместитель (обычно это водород) имел направление «от наблюдателя». Тогда если движение при переходе по кругу трех остальных заместителей от старшего к среднему по старшинству и затем к самому младшему происходит против часовой стрелки — это R-изомер (ассоциируется с таким же движением руки при написании буквы R), если по часовой стрелке — это S-изомер (ассоциируется с таким же движением руки при написании буквы S).
Для определения старшинства заместителей у асимметрического атома используются правила подсчета атомных номеров, уже рассматривавшиеся нами в связи с Z,E-номенклатурой геометрических изомеров (см. раздел II.2).
Для выбора R,S-обозначений по проекционной формуле необходимо путем четного числа перестановок (не изменяющих, как мы знаем, стереохимического смысла формулы) расположить заместители так, чтобы младший из них (обычно водород) оказался внизу проекционной формулы. Тогда старшинство остальных трех заместителей, падающее по часовой стрелке, соответствует обозначению R, против часовой стрелки — обозначению S [ПРИМ.9]:
3. Определите конфигурацию асимметрического центра аскорбиновой кислоты (витамина С) (по R,S-номенклатуре и по сравнению с глицериновым альдегидом):
4. Алкалоид эфедрин имеет формулу:
Дайте название этого соединения, используя R,S-номенклатуру.
5. Цистеин — заменимая аминокислота, участвующая в регуляции процессов обмена веществ, представляет собой L-1-амино-2-меркаптопропионовую кислоту. Изобразите его структурную формулу и дайте название по R,S-номенклатуре.
6. Левомицетин (антибиотик широкого спектра действия) представляет собой D(-)-трео-1-пара-нитрофенил-2-дихлорацетиламино-пропандиол-1,3. Изобразите его структуру в виде проекционной формулы Фишера.
7. Синэстрол — синтетический эстрогенный препарат нестероидного строения. Дайте его название с обозначением стереохимической конфигурации:
При замыкании цепи углеродных атомов в плоский цикл валентные углы атомов углерода вынуждены отклоняться от своего нормального тетраэдрического значения, причем величина этого отклонения зависит от числа атомов в цикле. Чем больше угол отклонения валентных связей, тем больше должен быть запас энергии молекулы, тем меньше устойчивость цикла. Однако, плоское строение имеет только трехчленный циклический углеводород (циклопропан); начиная с циклобутана молекулы циклоалканов имеют неплоское строение, что понижает «напряжение» в системе.
Молекула циклогексана может существовать в виде нескольких конформаций, в которых сохраняются «нормальные» валентные углы (для упрощения показаны только атомы углерода):
Энергетически наиболее выгодной является конформация I — так называемая форма «кресла«. Конформация II — «твист« — занимает промежуточное положение: она менее выгодна, чем конформация кресла (из-за наличия в ней заслоненно расположенных атомов водорода), но более выгодна, чем конформация III. Конформация III — «ванна« — наименее выгодна из трех вследствие значительного отталкивания направленных верх атомов водорода.
Рассмотрение двенадцати связей С-Н в конформации кресла позволяет разделить их на две группы: шесть аксиальных связей, направленных поочередно то вверх, то вниз, и шесть экваториальных связей, направленных в стороны. В монозамещенных циклогексанах заместитель может находиться либо в экваториальном, либо в аксиальном положении. Эти две конформации обычно находятся в равновесии и быстро переходят друг в друга через конформацию твист:
Экваториальная конформация (е) обычно беднее энергией и поэтому более выгодна, чем аксиальная (а).
При появлении в циклах заместителей (боковых цепей) кроме проблемы конформации самого цикла перед исследователем встают и проблемы конфигурации заместителей: так, в случае наличия двух одинаковых или различных заместителей появляются цис-транс-изомера. Отметим, что говорить о цис-транс-конфигурации заместителей имеет смысл только в приложении к насыщенным малым и средним циклам (до С8): в кольцах с большим числом звеньев подвижность становится уже столь значительной, что рассуждения о цис- или транс— положении заместителей теряют смысл.
Так, классическим примером являются стереоизомерные циклопропан-1,2-дикарбоновые кислоты. Существуют две стереоизомерные кислоты: одна из них, имеющая т.пл. 139 о С, способна образовывать циклический ангидрид и является, следовательно, цис-изомером. Другая стереоизомерная кислота с т.пл. 175 о С, циклического ангидрида не образует; это транс-изомер [ПРИМ.10]:
В таких же отношениях друг с другом находятся две стереоизомерные 1,2,2-триметилциклопентан-1,3-дикарбоновых кислоты. Одна из них, камфорная кислота, т.пл. 187 о С, образует ангидрид и, следовательно, является цис-изомером. Другая — изокамфорная кислота, т.пл. 171 о С, — ангидрида не образует, это транс-изомер:
Хотя молекула циклопентана на самом деле неплоская, для наглядности удобно изображать ее в плоском виде, как на приведенном выше рисунке, имея в виду, что в цис-изомере два заместителя находятся по одну сторону цикла, а в транс-изомере — по разные стороны цикла.
Дизамещенные производные циклогексана также могут существовать в цис- или транс-форме:
а) 1,2-дизамещенные циклогексаны:
б) 1,3-дизамещенные циклогексаны:
в) 1,4-дизамещенные циклогексаны:
Обратим внимание на то обстоятельство, что понятия цис- и транс- в производных циклогексана относительны: вместо двугранных углов между связями, равных нулю (цис-форма) или 180 о (транс-форма) в ряду циклогексана наблюдаются иные углы. Например, у 1,2-замещенных в обеих конфигурациях, как цис-, так и транс-, угол между валентными связями одинаков: он составляет всего 60 о , т.е. ближе к истинной цис-форме.
В этом разделе перечислены некоторые другие классы органических соединений, также обладающих оптической активностью (т.е. существующие в виде пар оптических антиподов.
Атом углерода не обладает монополией на создание хиральных центров в молекулах органических соединений. Центром хиральности могут быть также атомы кремния, олова, четырехковалентного азота в четвертичных аммониевых солях и окисях третичных аминов:
В этих соединениях центр асимметрии имеет тетраэдрическую конфигурацию, как и асимметрический атом углерода. Существуют, однако, и соединения с иной пространственной структурой хирального центра.
Пирамидальную конфигурацию имеют хиральные центры, образованные атомами трехвалентного азота, фосфора, мышьяка, сурьмы, серы. В принципе, центр асимметрии можно считать тетраэдрическим, если в качестве четвертого заместителя принять неподеленную электронную пару гетероатома:
Оптическая активность может возникать и без хирального центра, за счет хиральности структуры всей молекулы в целом (молекулярная хиральность или молекулярная асимметрия). Наиболее характерными примерами являются наличие хиральной оси либо хиральной плоскости.
Хиральная ось возникает, например, в алленах, содержащих различные заместители при sp 2 -гибридных углеродных атомах. Легко видеть, что приведенные ниже соединения являются зеркальными изображениями, а, значит, оптическими антиподами:
Ось хиральности показана на рисунках стрелкой.
Другой класс соединений, имеющих хиральную ось — оптически активные бифенилы, имеющие в орто-положениях объемистые заместители, затрудняющие свободное вращение вокруг С-С связи, соединяющей ареновые кольца:
Хиральная плоскость характеризуется тем, что у нее можно различить «верх» и «низ», а также «правую» и «левую» стороны. Примером соединений с хиральной плоскостью могут служить оптически активный транс-циклооктен и оптически активное производное ферроцена:
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
источник
Изомерия – это явление, обусловленное существованием молекул, имеющих одинаковый качественный и количественный состав, но различающихся по химическим и физическим свойствам вследствие неодинакового расположения атомов (или групп атомов) в молекуле или их ориентации в пространстве.
Известно, что свет представляет собой электромагнитные волны, фаза колебания которых, перпендикулярна направлению их распространения. В естественном свете такие колебания происходят во всех возможных плоскостях. Если же луч света пропустить через кристалл, имеющий строго упорядоченное строение (рис 1), то электромагнитные колебания будут совершаться только в одной определенной плоскости. Свет, фаза колебания которого вне этой плоскости, призмой задерживается. Такой луч света называется поляризованным (плоскополяризованным). Плоскость, перпендикулярная плоскости колебаний поляризованного света, является плоскостью поляризации. Обычно в качестве стереорегулярого кристалла используют так называемую призму Николи.
Рис. 1. Схематическое изображение электромагнитных колебаний в луче обыкновенного и поляризованного света; 1 — в обыкновенном свете; 2 — в поляризованном свете; 3 — плоскость поляризации; 4 — призма Николя
Оптически активные соединения «вращают» плоскость поляризации вправо или влево (рис.2). Для обозначения этих вращений используют знаки (+) и (-), которые ставят перед формулой оптического изомера.
Рис. 2. Изменение плоскости поляризации при прохождении поляризованного света через оптически активные вещества: 1 — оптически активное вещество, 2 — первоначальная плоскость поляризации, повернутая на угол α после прохождения света через оптически активное вещество.
Оптическая (зеркальная) изомерия обусловлена пространственной асимметрией молекул. Такие молекулы при одинаковом химическом строении не могут быть совмещены в пространстве ни при каких поворотах, подобно тому, как нельзя совместить правую и левую руки. Молекулы, обладающие оптической изомерией, как правило, имеют центр асимметрии. Этот центр называют асимметрическим или хиральным. Хиральный центр имеют соединения содержащие атом углерода в состоянии sp 3 -гибридизации, который содержит четыре разных заместителя: Xabcd.
Заметим что, асимметрические центры могут возникать не только у атома углерода, но и у других атомов, например, серы, азота, фосфора, кремния и т.д. Во многих случаях асимметричными являются молекулы комплексных соединений. При этом, в ряде случаев, роль одного из «заместителей» выполняет неподеленная пара электронов.
Пример оптически активного соединения – молочная кислота:
В молекуле молочной кислоты имеется хиральный центр, поэтому существуют два пространственных изомера, являющиеся зеркальными изомерами. Два стереоизомера, относящиеся друг к другу как предмет и его зеркальное отражение, называют антиподами, или энантиомерами. Антиподы отличаются только знаком оптического вращения.
По системе Фишера-Розанова конфигурации оптических изомеров подразделяют на два ряда: D и L. Необходимо помнить, что обозначения D и L не имеют ничего общего с направлением вращения плоскополяризованного света (правовращающий изомер можно обозначить буквой «d», а левовращающий – буквой «l», но не прописными буквами).
Если в стандартной проекционной формуле Фишера ОН-группа (или NH2 для аминокислот) стоит справа, то данный стереоизомер относят к D ряду, если слева, то к L-ряду.
Нечётное количество перестановок (1, 3 …) или поворот на 90° (270 0 ) меняют конфигурацию на противоположную.
Чётное количество перестановок (2, 4 …) или поворот на 180° не меняют конфигурацию.
Взаимная перестановка любых двух групп в проекциях Фишера приводит к превращению энантиомера в его зеркальное отображение:
D,L- номенклатуру продолжают применять для аминокислот, углеводов и многих других природных соединений. Однако данная система имеет ряд недостатков и в настоящее время для описания конфигураций новых соединений не применяется, а вместо нее используют систему Кана-Ингольда-Прелога (R,S-стереохимическая номенклатура).
Для описания абсолютных конфигураций в настоящее время используется система Кана-Ингольда-Прелога (Р. Кан, Д. Ингольд и В. Прелог, 1966) или R-S – система обозначений пространственной конфигурации соединений, в которой R обозначает правый (rectus), а S – левый (sinister). Обозначения R и S помещают в скобках перед названием структуры. Следует понимать, что обозначения абсолютных конфигураций, не связаны какой то зависимостью с физическим явлением — вращением плоскополяризованного луча, то есть знак + или – может стоять у значка R или S. Вместе с тем, изображенная в соответствии с этими правилами абсолютная конфигурация должна точно соответствовать истинному строению данной молекулы, подтвержденному экспериментальными данными.
Возьмем соединение Xabcd содержащее один асимметрический центр X. Чтобы установить его конфигурацию, четыре заместителя у атома X следует пронумеровать и расположить в ряд в порядке уменьшения старшинства 1>2>3>4.
Заместители рассматриваются наблюдателем со стороны, наиболее удаленной от самого младшего заместителя (обозначенного номером 4). Если при этом направление убывания старшинства остальных заместителей (младший не учитывается) 1®2®3 совпадает с движением по часовой стрелке, то конфигурация данного асимметрического центра обозначают символом R, а если против часовой стрелки – символом S.
(данное правило применимо и для анализа других изомеров, где необходимо рассмотреть старшинство заместителей, в частности для анализа конформаций и диастереомеров)
1. Отмечают атомный номер каждого из атомов, непосредственно присоединенных к рассматриваемому асимметрическому атому углерода.
2. Располагают эти атомы в порядке убывания атомного номера. Предпочтение по старшинству отдается атомам с более высокими атомными номерами. Если номера одинаковы (в случае изотопов), то более старшим считается атом с наибольшей атомной массой. Самый младший «заместитель» — неподеленная электронная пара. Таким образом, старшинство возрастает в ряду: неподеленная пара n , где N — число стереоизомеров,а n – число асимметрических атомов.
При рассмотрении 2-фтор-3-хлор-4-бромпентана можно убедиться, что количество изомеров 2 3 равно 8.
Существует четыре стереоизомера для молекул с двумя асимметрическими атомами углерода, которые показаны на рисунке, на примере 3-хлорбутанола-2 -СН 3СНОНСНСlCH3. Возникает ситуация когда молекулы в каждой паре изомеров А и В являются энантиомерами (оптическими изомерами). Если же мы сравним любой из изомеров группы А с любым стереоизомером группы В, то обнаружим, что они не являются зеркальными антиподами. Пространственные изомеры, не являющиеся энантиомерами по отношению друг к другу, называются диастереомерами. σ-Диастереомеры, в отличие от энантиомеров имеют различные физико-химические свойства и, как правило, отличающиеся химические свойства.
Любой из энантиомеров А является диастереомером по отношению к энантиомерам В
Могут реализоваться случаи, когда число изомеров меньше предсказываемого формулой 2 n . Такие случаи встречаются, когда в структуре существуют одинаковые асимметрические центры, то есть центры с одинаковым набором атомов или групп атомов, например, в 2,3-дибромбутане:
Молекулы I и II хиральны. Нетрудно видеть, что проекции III и IV изображают одно и то же соединение: эти проекции полностью совмещаются друг с другом при повороте на 180° в плоскости листа. В проекциях III и IV легко обнаруживается плоскость симметрии, перпендикулярная центральной С-С-связи и проходящая через ее середину. В данном случае проекции III и IV содержат асимметрические центры, но не обладают хиральностью, то есть проекции III и IV это одна и та же молекула, перевернутая на 180°. Вещества, состоящие из таких молекул, называют мезо-формами. Мезо-форма не способна вращать плоскость поляризации света, то есть она оптически неактивна.
Согласно определению, любой из энантиомеров I и II является σ-диастереомером по отношению к мезо-форме, то есть они отличаются физико-химическими и химическими свойствами.
В некоторых случаях для обозначения σ-диастереомеров используются традиционно применяющиеся в стереохимии дескрипторыэритро— и трео-. При этом сравнивают расположение одинаковых заместителей при двух асимметрических атомах в проекции Фишера. Стереоизомеры, в которых одинаковые заместители при асимметрических атомах углерода расположены по одну сторону от вертикальной линии, называют эритро-изомерами. Если такие группы находятся по разные стороны от вертикальной линии, то говорят о трео-изомерах. В изомерах 3-хлорбутанола-2 (I) -(IV) такими реперными группами являются атомы водорода, и эти соединения получают следующие названия:
Приставки эритро— и трео— происходят от названий углеводов: треозы и эритрозы.
В случае соединений с большим числом асимметрических центров иногда применяют другие стереохимические дескрипторы, также происходящие от названий углеводов (рибо-, ликсо-, глюко— и т.п.).
Геометрическая изомерия – это стереоизомерия, обусловленная различным расположением заместителей вокруг двойных связей. Если оба заместителя располагаются по одну сторону от двойной связи, то это цис-изомер, если по разные строны, то это транс-изомер. Транс-измеры энергетически более устойчивы вследствие наименьшего взаимного отталкивания заместителей. Отметим, что геометрических изомеров не образуют соединения у который двойная связь располагается у концевого атома углерода. Пример:
Сложнее ситуация когда в алкене различные заместители. В современной номенклатуре правила последовательного старшинства применимы также и к описанию геометрических изомеров непредельных соединений. Заместители у каждого конца кратной связи при установлении старшинства должны рассматриваться отдельно. Если заместители, имеющие более высокое старшинство, расположены с одной и той же стороны двойной связи, соединению присваивают префикс Z (от немецкого zusammen – вместе), а если по разным сторонам, то префикс E (entgegen – напротив).
Z, E-Номенклатура распространена и на прочие геометрические изомеры, в которых π-диастереомерия определяется наличием C=N –связи или к примеру C=P-связи. В качестве четвертого заместителя рассматривают n-электроны на атоме азота (нольвалентный заместитель).
Цис,транс-изомерия, а также и син,анти-изомерия распространена в химии не только на соединения с кратными связями, но и на циклические и каркасные соединения.
Молекулы промышленно важного углеводорода А (DH2 = 13) в присутствии катализаторов образуют различные олигомеры:
Из углеводородов А и В были получены изомерные углеводороды I–VI согласно приведенной ниже схеме превращений:
2. Напишите структурные формулы I–V, F–О. чтите, что превращения F в G и K в L – изомеризации. Помните, что разные буквы не могут обозначать одно и то же вещество.
источник
При изображении стереоизомеров часто пользуются формулами Фишера. В этих формулах хиральный центр рисуют с четырьмя связями, образующими друг с другом прямые углы. Вертикальные линии изображают проекцию на плоскость заместителей, находящихся за плоскостью, в то время как горизонтальные линии — это проекция заместителей, находящихся перед плоскостью. Символ асимметрического атома углерода в проекционных формулах Фишера принято опускать.
До 1951 г. установление абсолютной конфигурации было невозможно. Розанов в 1906 г предложил использовать в качестве относительного стандарта правовращающий (+) глицериновый альдегид, которому произвольно приписали конфигурацию D. Левовращающий антипод обозначили буквой L.
D-глицериновый альдегид L-глицериновый альдегид
В формулах Фишера самая длинная углеродная цепь записывается вертикально с атомом углерода №1 наверху; вертикальные связи асимметрического атома углерода располагаются за плоскостью чертежа, а горизонтальные над плоскостью.
D-молочная кислота L-молочная кислота
Если в проекции Фишера поменять местами две соседние группы, то получим зеркальное изображение исходного соединения. Зеркальное изображение начальной структуры получается и при повороте проекции Фишера на 90 о .
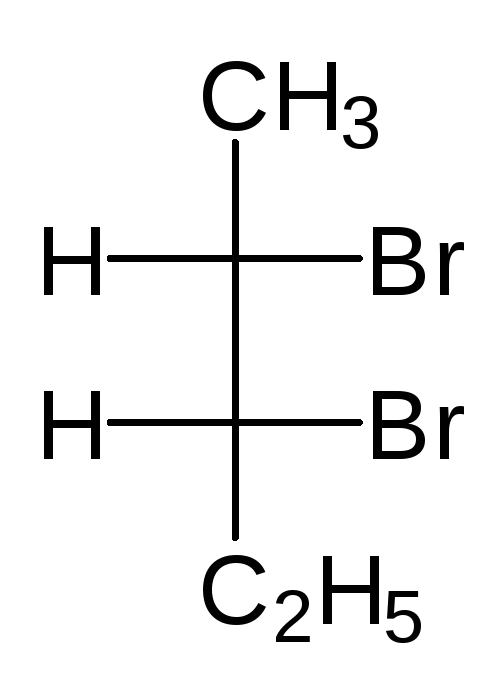
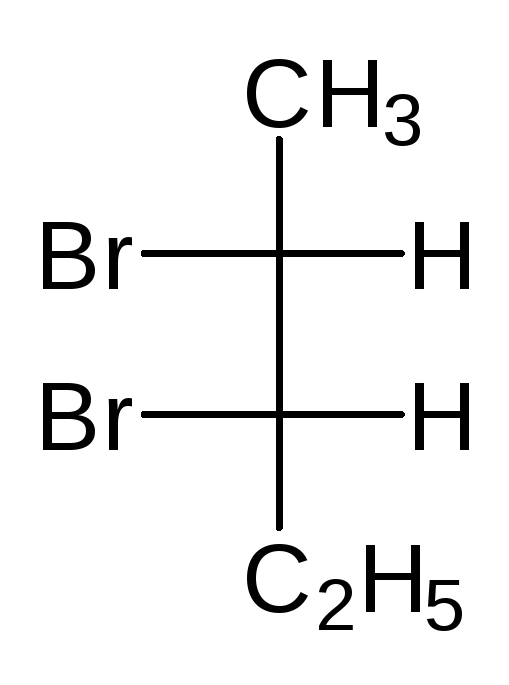
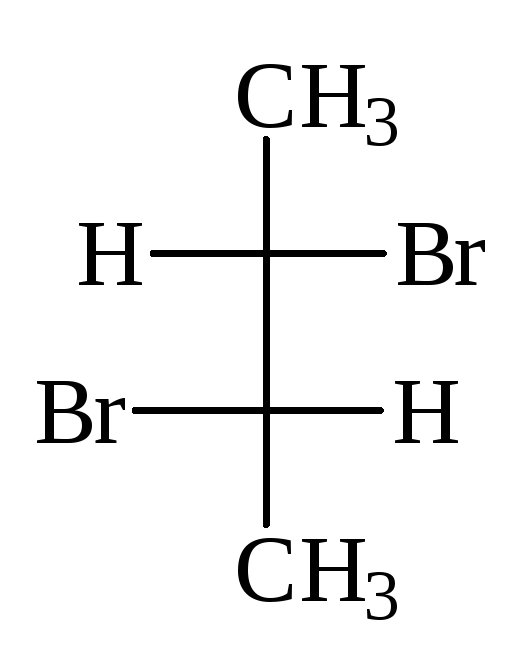
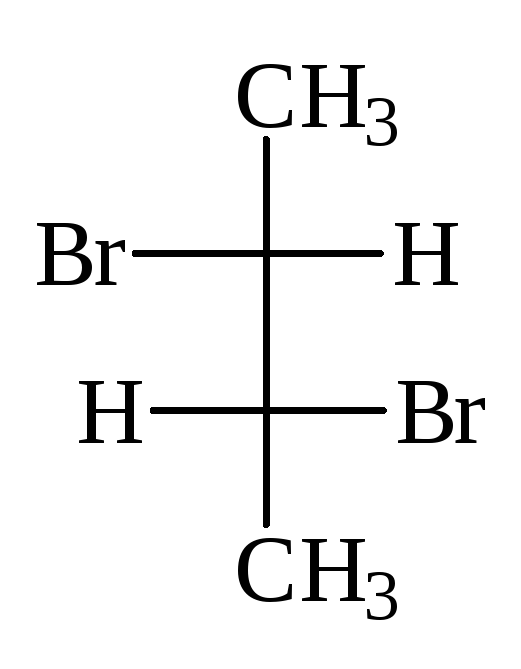
В виде диастереомеров могут существовать соединения, молекулы которых имеют два и более стереоцентров. С увеличением числа асимметрических атомов углерода число стереоизомеров увеличивается с появлением каждого нового стереоцентра и может быть вычислено по формуле N = 2 n , где n – число стереоцентров. Молекулы с двумя асимметрическими атомами углерода могут существовать в виде четырех стереоизомеров. Например, в молекуле 2,3-дибромпентана имеется два стереоцентра и, следовательно, у этого соединения 4 стереоизомера.
(2S,3R)-2,3-дибромпентан (2R,3S)-2,3-ди… (2S,3S)-2,3-ди… (23,3R)-2,3-ди…
Пары стереоизомеров (I) и (II), также (III) и (IV) относятся друг к другу как предмет и несовместимое с ним зеркальное изображение, т.е. являются парами энантиомеров. Стереоизомеры в любых других парах являются диастереомерами. Две различные конфигурации одной молекулы, но не являющиеся энантиомерами, называются диастереомерами. Два диастереомера различаются по всем свойствам и сравнительно легко разделяются, как два различных соединения.
В проекционных формулах (I) и (II) одинаковые лиганды находятся по одну сторону проекции, такие стереоизомеры называют эритро-формами. В формулах (III) и (IV) эти же лиганды находятся по разные стороны вертикальной линии проекции Фишера, соответствующие им соединения называют трео-формами.
У структуры с двумя стереоцентрами не всегда может быть 4 стереоизомера. Например, у 2,3-дибромбутана имеется два стереоцентра, но не 4 а только 3 стереоизомера.
(2S,3R)-2,3-дибромбутан (2S,3S)-2,3-ди… (2R,3R)-2,3-ди…
Нумеровать атомы 2,3-дибромбутана можно сверху вниз или снизу вверх и тогда видно, что первые две структуры изображают один и тот же стереоизомер. Этот стереоизомер ахирален и оптически не активен, т. к. имеет плоскость симметрии
Упр. 7. Изобразите формулы Фишера пространственных изомеров: (а) глицеринового альдегида (2,3-дигидроксипропаналя), (б) молочной (2-гидроксипропа-новой) кислоты, (в) яблочной (2-гидроксибутандиовой или гидроксиянтарной) кислоты, (г) винной (2,3-дигидроксибутандиовой или дигидроксиянтарной) кислоты.
Алкены и их производные с общей формулой ABC=CDE могут существовать в виде -диастереомеров. -Диастереомеры возникают при условии неидентичности лигандов, связанных с отдельными атомами углерода двойной связи. -Диастерео-меры отличаются друг от друга различным расположением лигандов относительно проскости симметрии -связи.
О заместителях, расположенных по одну сторону от двойной связи, говорят, что они находятся в цис-положении относительно друг друга; если они расположены по разные стороны от плоскости двойной связи, то это транс-положение. В последнее время вместо терминов цис- и транс— рекомендуется Z,E-система. Если две наиболее старшие группы (по системе Кана-Ингольда-Прелога) расположены по одну сторону от -связи, то конфигурация заместителей обозначается символом Z, если же эти группы находятся по разные стороны от плоскости -связи, то конфигурация обозначается символом Е.
Таким образом, мы обсудили два вида диастереоизомерии:
— диастереоизомерия возникающая в результате комбинации элементов хиральности (в этом случае диастереоизомерия и энантиомерия накладываются друг на друга);
источник