Природные тетрациклины. К этой группе относятся полиоксиполикарбонильные соединения, основой химической структуры которых является частично гидрированный цикл тетрацена (нафтацена):
В медицине применяют тетрациклин и окситетрациклина дигидрат.
Тетрациклин был получен в 1953 г. путем каталитического гидрирования хлортетрациклина, впервые выделенного из почвы в 1948 г. М. Дуггаром.
Окситетрациклин отличается от тетрациклина наличием гидроксида в положении 5, поэтому их общая формула имеет вид
Для получения природных антибиотиков тетрациклинового ряда используют микроорганизмы Streptomyces aureofaciens и Streptomyces rimosus.
По физическим свойствам природные тетрациклины — кристаллические вещества желтого или светло-желтого цвета, без запаха. Растворы в хлороводородной кислоте вращают плоскость поляризованного света влево, поэтому удельное вращение является одной из физических констант, подтверждающих подлинность.
Тетрациклин и окситетрациклина дигидрат являются основаниями, поэтому тетрациклин очень мало растворим, а окситетрациклин практически нерастворим в воде; оба умеренно растворимы в этаноле. В воде и этаноле тетрациклин растворяется медленно. В хлороформе и эфире они практически нерастворимы или мало растворимы. Тетрациклин и окситетрациклина дигидрат легко растворимы в разведенных кислотах и щелочах, т.к. являются амфотерными соединениями. Обладают основными свойствами, обусловленными наличием в молекуле диметиламиногруппы, и поэтому вступают во взаимодействие с органическими и неорганическими кислотами, образуя непрочные соли. Проявляют кислотные свойства за счет фенольных и енольных гидроксилов и дают соли с гидроксидами щелочных металлов. Образуют нерастворимые внутрикомплексные соединения с полизарядными катионами (кальция, магния, алюминия, железа, меди).
Указанные химические свойства лежат в основе испытаний доброкачественности тетрациклинов.
В качестве общих реактивов на тетрациклины используют соли меди, цинка, образующие окрашенные комплексы «разбавленную хлороводородную кислоту, в присутствии которой растворы тетрациклинов приобретают желтое окрашивание с зеленоватым, тетрациклин оттенком или оранжево-красную окраску окситетрациклин.
Подлинность тетрациклинов устанавливают с помощью цветных реакций. Реактивом, позволяющим отличать антибиотики друг от друга, является концентрированная серная кислота, под действием дегидратирующего воздействия которой образуются окрашенные ангидропроизводные:
В среде концентрированной серной кислоты ангидропроизводные тетрациклина окрашиваются в фиолетовый цвет, тетрациклина — в пурпурно-красный. При последующем добавлении к окрашенному раствору тетрациклина хлорида железа (III) фиолетовая окраска переходит в коричневую или красно-коричневую, окситетрациклина дигидрат по действием хлорида железа (III) в спиртовой среде приобретает коричневую окраску.
Окрашивание продуктов обусловлено наличием фенольных гидроксилов в молекулах.
Способность тетрациклинов окисляться с образованием окрашенных продуктов позволяет использовать для их идентификации такие окислители, как хлорамин Б, селенистая кислота, нингидрин в различных растворителях. Указанные реактивы позволяют идентифицировать тетрациклины и отличать их друг от друга.
Известны также цветные реакции на антибиотики этой группы с нитропруссидом натрия, диметиламинобензальдегидом, реактивом Несслера. Наличие в молекулах фенольных гидроксилов обусловливает образование имеющих красное окрашивание азокрасителей при взаимодействии с различными диазосоединениями, которые присоединяются в положен 9.
Для качественного анализа антибиотиков тетрациклинового ряда используют также их способность образовывать в определенных условиях флуоресцирующие продукты. Так, при действии раствором гидроксида натрия происходит изомеризация с образованием изотетрациклина, имеющего голубую флуоресценцию в УФ-свете после нагревания в кипящей водяной бане.
Тетрациклин и окситетрациклин имеют в молекулах по две системы сопряженных связей и поэтому характеризуются наличием двух полос электронного поглощения. Для аналитических целей представляет интерес длинноволновая полоса, обусловленная присутствием в молекулах карбонильных групп. Удельный показатель поглощения раствора тетрациклина при длине волны 380 нм должен быть равен 380-419,раствор сравнения — 0,1 М хлороводородная кислота. Подлинность окситетрациклина подтверждают по величине оптической плотности 0,002%-ного раствора в хлороводородной кислоте при длине волны 353 нм.
Подлинность тетрациклинов по ФС и МФ подтверждают, используя метод ТСХ. Тетрациклин растворяют в метаноле и хроматографируют относительно стандартных образцов на пластинках с закрепленным слоем силикагеля марки КСК 2,5 или пластинках «Сорбфил» в системе ацетон — вода (10:1,4). Для окситетрациклина используют систему этилацетат — ацетон — вода (20:19:1). После высушивания пластинку выдерживают в парах аммиака и просматривают в УФ-свете 366 нм. Зоны испытуемых и стандартных образцов должны быть идентичными.
При выполнении испытаний начистоту по ФС в тетрациклине устанавливают спектрофотометрическим методом присутствие светопоглощающих примесей при длине волны 430 нм. Величина оптической плотности должна быть не более 0,5. При аналогичном испытании 0,2%-ного раствора окситетрациклина оптическая плотность при 430 нм должна быть не более 0,25, а при 490 нм — не более 0,2. Методом ТСХ подобно испытанию подлинности обнаруживают присутствие специфических примесей. Указанные примеси ФС рекомендует устанавливать также методом ВЭЖХ. Методом ГЖХ определяют содержание остаточных растворителей (метанола, изооктанола).
Тетрациклин количественно определяют методом неводного титрования 0,1 М раствором хлорной кислоты. Титруют в смеси муравьиной, ледяной уксусной кислоты и диоксана (5:10:10). Эквивалентную точку устанавливают потенциометрически.
Сравнительные исследования показали сопоставимые результаты при количественном определении окситетрациклина на биологическим и дифференциальным спектрофотометрическим методами. В качестве растворителя использован 0,01 М раствор хлороводородной кислоты, аналитическая длина волны 353 нм Разработана также методика дифференциального фотоколориметрического определения тетрациклина гидрохлорида с использованием в качестве реактива хлорамина Б в щелочной среде.
Биологическую активность тетрациклиновых антибиотиков определяют способом диффузии в агар с тест-культурой,Р Bacillus siibtilis (ГФ XI, вып. 2, с. 210). Один мнкрограмм химически чистого лекарственного вещества соответствуе цнфпческой активности, равной одной единице действия. Следовательно, 1,0 г соответствует 1 000 000 ЕД.
Оценку биологической активности природных тетрациклинов можно также осуществить методом обратной тур° метрии с тест-культурой Staphylococcus aureus 209 Р. Степень мутности измеряют на фотоэлектроколориметре со светофильтром №7 582 нм.
Применяют так же способы фотоколориметрического определения, основанные на использовании цветных реакций с раствором хлорида железа (III), с диазосоединениями, хлорамином Б в щелочной среде и другими реактивами. Известны способы флуорометрического определения.
Лекарственные препараты тетрациклинов хранят по списку Б, в сухом, защищенном от света месте, при комнатной температуре. Упаковывают в стеклянные, хорошо укупоренные банки оранжевого стекла с навинчивающимися крышками залитыми парафином, или в другую подходящую тару. При хранении тетрациклина и окситетрациклина наблюдается изменение окраски. На свету они темнеют. Это является следствием образования примеси 4-эпитетрациклина, ангидротетрациклина, 4-эпиангидротетрациклина и продуктов дальнейшего превращения. Указанные вещества отличаются меньшей биологической активностью и более высокой токсичностью, чем исходные лекарственные вещества.
В растворах кислот и щелочей,особенно при нагревании, тетрациклин и окситетрациклин легко разрушаются. Инактивация щелочных растворов обусловлена образованием изотетрациклиновых производных. Например, тетрациклин превращается изотетрациклин.
Идентичные продукты образует окситетрациклин.
Тетрациклин и окситетрациклин — антибактериальные средства. Их механизм действия основан на подавлении биосинтеза белка микробной клетки. Применяют при пневмонии, бактериальной и амебной дизентерии, коклюше, гонорее, бруцеллезе, туляремии, сыпном и возвратном тифе и других инфекционных заболеваниях внутрь в виде таблеток, капсул, суспензии по 0,1-0,2-0,3 г 3-5 раз вдень. Наружно назначают 1-3%-ные мази для лечения глазных заболеваний, ожогов, флегмон.
Одним из недостатков природных тетрациклинов является сравнительно высокая токсичность. В результате исследований, проведенных в нашей стране и за рубежом, созданы полусинтетические аналоги природных тетрациклинов: доксициклин (вибрамицин), метациклин (рондомицин) и др.
Общая формула полусинтетических тетрациклинов:
Производные 6-дезокситетрациклина получают из окситетрациклина, изменяя структуру молекулы в положении 6. Дезоксилирование приводит к образованию доксициклина (6-дезокси-5-окситетрациклина), а последующее превращение метильной группы в метиленовую дает возможность получить метациклин (6-дезокси-6-деметил-6-метилен-5-окситетрациклин):
Способы испытаний на подлинность, чистоту и количественная оценка синтетических и природных тетрациклинов во многом сходны.
Doxycycline Hydrochloride — доксициклина гидрохлорид.
Methacycline Hydrochloride — метациклина гидрохлорид.
Доксициклина гидрохлорид легко, но медленно растворим в воде 1:3, легко растворим в метаноле 1:4 и мало -в этаноле. Метациклина гидрохлорид трудно и медленно в течение 40 мин растворим вводе 1:80 и в метаноле 1:40. В эфире и хлороформе оба практически нерастворимы.
Подлинность лекарственных веществ устанавливают по ИК-спектрам, сравнивая их со спектрами стандартных образцов. Методом УФ-спектрофотометрии подлинность подтверждают по удельному показателю поглощения, который у доксициклина гидрохлорида 280-310 устанавливают при длине волны 349 нм, растворитель — смесь 1 М раствора хлороводородной кислоты и метанола 1:99, а у метациклина гидрохлорида при 345 нм. УФ-спектр раствора метациклина гидрохлорида в области 220-400 нм в том же растворителе имеет максимумы поглощения при 253 и 345 нм и минимумы при 223 и 299 нм. При длине волны 345 нм со стандартным раствором устанавливают относительную оптическую плотность метациклина, которая должна быть равна от 96 до 104%.
Доксициклин и метациклин дают цветные реакции с серной кислотой желтое окрашивание и хлоридом железа (Ш), темное красно-коричневое окрашивание. Они дают также положительную реакцию на хлориды. Для установления подлинности и испытаний на наличие специфических примесей применяют метол ТСХ. аналогично испытаниям природных тетрациклинов.
Испытывают на наличие светопоглощающих примесей, измеряя оптическую плотность 1%-ных растворов полусинтетических тетрациклинов в смеси хлороводородной кислоты и метанола 1:99. Она должна быть не более 0,1. Методом ГЖХ в доксициклина гидрохлорида устанавливают наличие примеси этанола, методом К. Фишера — воды. В метациклине гидрохлориде меркуриметрическим методом количественно определяют содержание хлоридов не менее 7,0% и не более 7,8%; в качестве индикатора используют раствор дифенилкарбазона.
Биологическую активность препаратов определяют методом диффузии в агар с тест-культурой Bacillus subtilis.
Хранят лекарственные препараты полусинтетических тетрациклинов по списку Б, в сухом, защищенном от света месте, при комнатной температуре. Даже в темноте, особенно во влажной атмосфере и при повышении температуры, они постепенно разлагаются. Выпускают в капсулах- доксициклина гидрохлорида 0,05, 0,1 и 0,2 г, метациклина гидрохлорида по 0,15 и 0,3 г. Показания для применения у полусинтетических тетрациклинов те же, что и у природных, но вследствие лучшей растворимости они быстрее всасываются, дольше сохраняются до 24 ч в крови, а также отличаются меньшей токсичностью.
источник
Производные нафтохинонов ( витамины группы К ) — филлохинон.
Синтетический витамин К1 – фитоменадион. Синтетический водорастворимый – менадиона натрия бисульфит — Викасол. Тетрациклины. Тетрациклин, окситетрациклин, их полусинтетические производные: метациклин, доксициклин ( Вибрамицин ).
Установлено, что К-витаминной активностью (стимулирование свёртываемости крови) обладают вещества общей формулы:
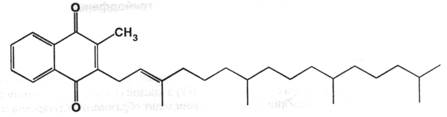
Заместители у двойной связи в транс-положении. Биосинтез витамина К1 осуществляется в зелёных частях растений, так как фитол ( R его остаток ) является составной частью хлорофилла. Биосинтез стимулируется солнечным светом, поэтому ботва моркови богаче К1 чем корень, наружные листья капусты в 4 богаче витамином, чем внутренние. Этот витамин широко распространён в природе в зеленых частях таких растений как шпинат, цветная капуста, зелёные томаты, листья люцерны. Возможно промышленное получение витамина из подобного сырья. Синтез осложнён получением фитола; предложенные пути синтеза затратны и представляют только теоретический интерес. Синтетический витамин К1 представляет собой смесь цис- и транс-изомеров в соотношении (3:7); при этом биологической активностью обладает только транс-изомер. Синтез основан на алкилировании фитолом
2-метил-1,4-дигидроксинафталина с последующим окислением:
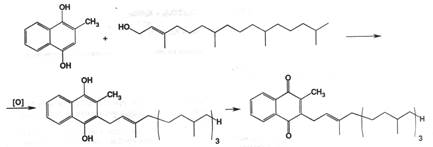
Phytomenadione. Фитоменадион ( Вит К1 ) нефармакопейный препарат
Получение: см. выше синтез из2-метил-1,4-дигидроксинафталина и спирта фитола.
Описание: жёлтая или оранжево-жёлтая прозрачная жидкость со слабым запахом.
Растворимость: практически нерастворима в воде, мало растворима в этаноле, легко – в гексане, хлороформе, эфире, растительных маслах.
Подлинность: по ФС – цветной реакцией; раствор препарата в метаноле с 20% раствором гидроксида натрия приобретает зелёное окрашивание, при нагревании до 50 С переходящее в фиолетово-красное. Также подлинность подтверждают по УФ-спектру 0,001% раствора в гексане.
Чистота: может быть установлена по наличию поглощающих примесей по величинам отношений оптических плотностей гексановых растворов ( 0,001% и 0,008% ), а также методом ТСХ на примеси нафтотокоферилхинона и фитодиенов ( не более 2% ).
Количественное определение: УФ-спектрофотометрия в растворе гексана при длине волны 248 нм. Содержание вычисляют по величине удельного показателя поглощения.
Хранение: в сухом, защищённом от света месте, в хорошо укупоренной таре, стараясь не допустить контакта с кислородом воздуха.
Применение: обладает антигеморрагической и коагуляционной активностью, для лечения кровотечений.
Форма выпуска: капсулы по 0,1 в виде 10% масляного раствора.
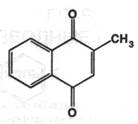
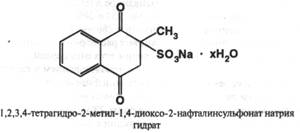
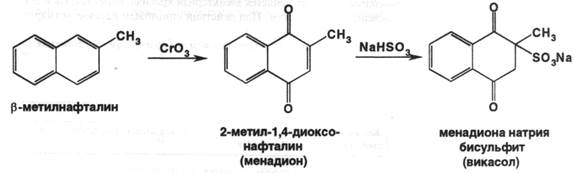
Получение: синтезом из β-метилнафталина.
Описание: белый или белый с желтоватым оттенком кристаллический порошок без запаха.
Растворимость: легко растворим в воде, трудно растворим в 95% спирте, мало растворим в эфире.
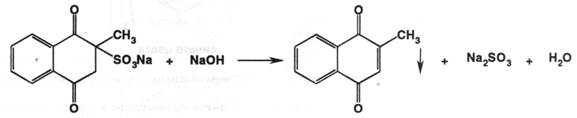
2) препарат даёт характерную реакцию Б на натрий – пламя окрашивается в жёлтый цвет.
ФС также предлагает реакции 2 и 3 для подтверждения подлинности препарата, а также чтобы ИК-спектр препарата, запрессованного в таблетку калия бромида, полностью соответствовал приложенному к ФС рисунку спектра. УФ-спектр 0,002% водного раствора в области 280-340 нм имеет максимум поглощения при 305 нм. Это может быть использовано для испытаний на подлинность и для количественного определения. Имеются другие качественные реакции на препарат: 1) с этилатом натрия – образуется неустойчивая фиолетовая окраска, которая переходит в красную, а затем в устойчивую коричневую, которую уже можно использовать для фотоколориметрического определения. 2) производные 1,4-диоксонафталина в щелочной среде реагируют с 5% спиртовым раствором диэтилдитиокарбамата натрия с появлением неустойчивой синей окраски.
Чистота: в препарате устанавливают отсутствие побочных продуктов синтеза – 2-метил-1,4-дигидрокси-3-нафталинсульфоната натрия ( по реакции с орто-фенантролином – не должна появляться муть ); натрия бисульфита – методом йодометрии ( не более 2% ). Также ГФ требует определения прозрачности и цветности раствора, лимитируется количество тяжёлых металлов. ФС дополнительно требует установки микробиологической чистоты и определения воды по К. Фишеру ( не менее 12% и не более 16,5% ).
Действующего вещества в препарате должно быть не менее 95,0%.
Хранение: список Б; в сухом, защищённом от света месте; в.р.д. внутрь 0,03; в.с.д. внутрь 0,06 г.
Применение: препарат витамина К; для предупреждения кровотечений.
Форма выпуска: порошок, таблетки по 0,015 г, 1% раствор в ампулах по 1 мл.
Антибиотики тетрациклинового ряда
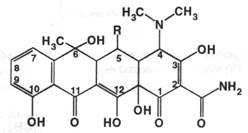
Впервые получен в 1948 году из почв штата Миссури Дуггаром из актиномицета ауреомицин. В СССР аналогичный антибиотик получен в 1952 году ( хлортетрациклин ). В настоящее время в медицине применяют тетрациклин и окситетрациклина дигидрат. Окситетрациклин отличается от тетрациклина наличием гидроксильной группировки в положении 5. Получают их биотехнологиями из культуральной жидкости микроорганизмов Streptomyces aureofaciens и Streptomyces rimosus. Питательной средой служит жидкость, содержащая кукурузный экстракт, кукурузную муку, бромид натрия, роданид бензила, роданид и нитрат аммония, металлы Mg, Mn, Fe, Cu, Zn в виде сульфатов, подсолнечное масло. Меняя состав среды можно направлять биосинтез по пути преимущественного образования того или иного антибиотика. В химическом отношении препараты являются амфотерными соединениями и легко растворяются в кислотах и щелочах. Основные свойства обусловлены наличием диметиламиногруппы ( по ней идёт протонирование ), а кислотные свойства обусловлены фенольными и енольными гидроксилами ( дают соли с гидроксидами щелочных металлов ); с многозарядными катионами образуют хелаты ( внутрикомплексные соединения ). В качестве общих реактивов, позволяющих отличать препараты друг от друга применяются концентрированная серная и разведённая хлороводородная кислоты. В качестве цветных реагентов можно использовать соли меди и цинка. Тетрациклины могут окисляться, образуя окрашенные продукты с такими реагентами, как селенистая кислота, хлорамин Б ( нефармакопейные реакции ). Возможно получение азокрасителя в реакции с диазосоединениями, которые присоединяются в 9 положение:
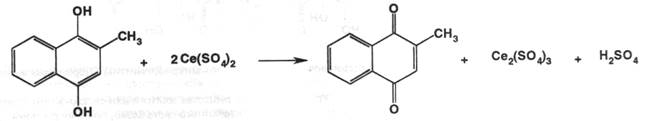
На основе этой реакции можно проводить колориметрическое определение.
Tetracyclinum ( Tetracycline ). Тетрациклинфармакопейный препарат
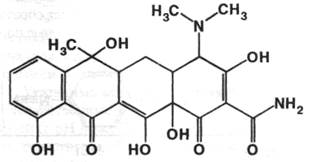
Получение: методом биотехнологии ( см. выше ).
Описание: жёлтый кристаллический порошок без запаха, горького вкуса. Гигроскопичен. Легко разрушается в растворах крепких щелочей. При хранении на свету темнеет.
Растворимость: очень мало растворим в воде, трудно растворим в 95% спирте.
Чистота: по ФС методом ТСХ устанавливают присутствие специфических примесей (эпитетрациклины). Методом УФ-спектрофотометрии определяют присутствие светопоглощающих примесей – при 430 нм величина оптической плотности не должна превышать 0,5. Это же можно установить методом ВЭЖХ. Методом ГЖХ устанавливают наличие остаточных растворителей.
Также по ГФX определяют удельное вращение, кислотность или щелочность, воду по К. Фишеру, проводят испытание на токсичность ( ГФXI, вып. 2, с. 182 ).
Количественное определение:по ФС – метод неводного титрования 0,1 М хлорной кислотой в среде смеси муравьиной, ледяной уксусной кислоты и диоксана ( 5:10:10 ), точку эквивалентности устанавливают потенциометрически. По ГФX определяют биологическим методом диффузии в агар с тест-микробом Bacillus subtilis вариант Л ( новая методика – ГФXI, вып. 2, с. 210 ). 1 г препарата соответствует 1 000 000 ЕД.
Хранение:список Б; в сухом, защищённом от света месте, при комнатной температуре.
Применение: антибиотик широкого спектра действия. Применяется при пневмонии, дизентерии, сыпном и возвратном тифе, гонорее.
Форма выпуска: таблетки, покрытые оболочкой по 0,05; 0,1; 0,25; мазь глазная 1% в тубах по 3, 7 и 10 г.
Oxytetracyclini dihydras ( Oxytetracycline ). Окситетрациклинфармакопейный препарат
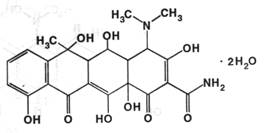
Описание: светло-жёлтый кристаллический порошок без запаха. При хранении на свету темнеет.
Растворимость: мало растворим в воде, легко растворим в кислотах и щелочах.
Подлинность: по ГФX 1) к 0,05 г препарата прибавляют 5 мл концентрированной серной кислоты; появляется пурпурно-красное окрашивание. 2) к 1 мл 0,5% суспензии препарата прибавляют 2 капли раствора, состоящего из одной части хлорида окисного железа и 9 частей 95% спирта; появляется коричневая окраска. Это обусловлено наличием фенольных гидроксилов.
Возможно применение других цветных реакций, описанных выше. По ФС показатель оптической плотности 0,002% раствора препарата в хлороводородной кислоте должен быть в пределе 0,54-0,58 при длине волны 353 нм. Также подлинность подтверждают методом ТСХ; хроматографируют со стандартными образцами на пластинке “Сорбфил” в системе этилацетат-ацетон-вода ( 20:19:1 ). Проявляют парами аммиака, смотрят в УФ-свете.
Чистота: по ФС оптическая плотность 0,2% раствора препарата при 430 нм должна быть не более 0,25, а при 490 нм – не более 0,2; методами ТСХ и ВЭЖХ выясняют присутствие специфических примесей эпитетрациклинов. Методом ГЖХ устанавливают наличие остаточных растворителей.По ГФX также определяют удельное вращение, кислотность или щелочность, воду по К. Фишеру, токсичность ( ГФXI, вып. 2, с. 182 ).
Количественное определение: по ГФX – методом диффузии в агар с тест-микробомBacillus subtilis вариант Л ( новая методика – ГФXI, вып. 2, с. 210 );
Можно определять методами спектрофотометрии в 0,01 М растворе хлороводородной кислоты при 353 нм; обратной турбидиметрией с тест-культурой золотистого стафилококка; различные методы фотоколориметрии.
Хранение:список Б; в сухом, защищённом от света месте, при комнатной температуре.
Применение: антибиотик широкого спектра действия. Применяется при пневмонии, дизентерии, сыпном и возвратном тифе, гонорее.
Форма выпуска: таблетки по 0,25; входит в состав многокомпонентных мазей.
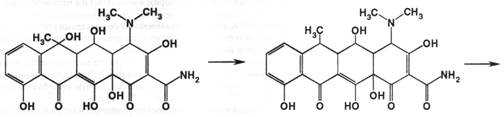
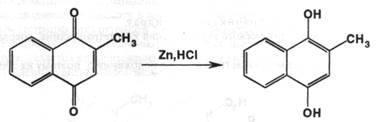
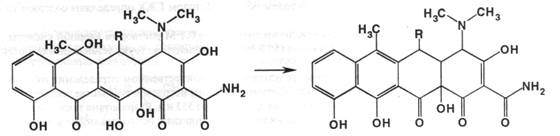
Они были созданы из природных тетрациклинов для уменьшения токсичности препаратов для макроорганизма. Их получают из окситетрациклина, изменяя структуру молекулы в положении 6. Дезоксилирование приводит к получению доксициклина, а последующее превращение метильной группы в метиленовую даёт другой полусинтетический препарат – метациклин:
Способы испытаний на подлинность, чистоту и количественное определение во многом подобны природным тетрациклинам.
Doxycyclini hydrochloridum ( Doxycycline hydrochloride, Vibramycin ). Доксициклина гидрохлорид ( Вибрамицин ) нефармакопейный препарат
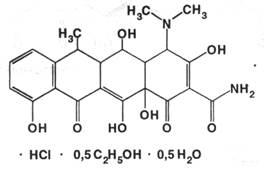
Описание: жёлтый кристаллический порошок со слабым запахом этилового спирта.
Растворимость: легко, но медленно растворим в воде, легко растворим в метаноле (1:4), мало растворим в этаноле, практически нерастворим в эфире и хлороформе.
Подлинность: 1) устанавливается по ИК-спектру в сравнении с приложенным к статье рисунком; 2) по удельному показателю поглощения ( 280-310 ) при длине волны 349 нм ( в смеси 1 М раствор хлороводородной кислоты – метанол 1:99 ); 3) оба препарата дают реакцию с концентрированной серной кислотой ( жёлтое окрашивание) и хлоридом окисного железе – красно-коричневое окрашивание; 4) реакция на хлориды. Также можно использовать метод ТСХ в сравнении со стандартным веществом-свидетелем.
Чистота: этот же метод ТСХ используется для определения специфических примесей эпитетрациклинов. Проводят испытания на наличие светопоглощающих примесей, измеряя оптическую плотность 1% раствора препарата в системе растворителей хлороводородная кислота-метанол ( 1:99 ), она не должна превышать 0,1. Методом ГЖХ определяют наличие примеси этанола ( 4-6% ), воду – методом К. Фишера ( 1,4-2,8 ).
Количественное определение: методом диффузии в агар с тест-микробомBacillus subtilis ( ГФXI, вып. 2, с. 210 ).
Хранение:список Б; в сухом, защищённом от света месте, при комнатной температуре.
Применение: антибиотик широкого спектра действия. Применяется при пневмонии, дизентерии, сыпном и возвратном тифе, гонорее.
Форма выпуска: капсулы по 0,05; 0,1; 0,2 г.
Methacyclini hydrochloridum (Methacycline hydrochloride). Метациклина гидрохлорид (Рондомицин)нефармакопейный препарат
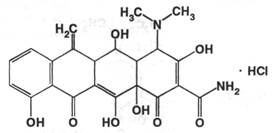
Описание: жёлтый порошок без запаха, горького вкуса.
Растворимость: трудно и медленно растворим в воде и метаноле ( 1:40 ), практически нерастворим в хлороформе и эфире.
Подлинность: 1) устанавливается по ИК-спектру в сравнении с приложенным к статье рисунком; 2) при длине волны 345 нм со стандартным раствором устанавливают относительную оптическую плотность метациклина, которая должна быть в пределах от 96 до 104%. 3) реакция на хлориды; 4) используют реакции, свойственные этой группе препаратов.
Чистота: проводят испытания на наличие светопоглощающих примесей, измеряя оптическую плотность 1% раствора препарата в системе растворителей хлороводородная кислота-метанол ( 1:99 ), она не должна превышать 0,1. Содержание хлоридов определяют меркуриметрически (не менее 7% и не более 7,8%), индикатор – дифенилкарбазон.
Количественное определение: методом диффузии в агар с тест-микробомBacillus subtilis ( ГФXI, вып. 2, с. 210 ).
Хранение:список Б; в сухом, защищённом от света месте, при комнатной температуре.
Применение: антибиотик широкого спектра действия. Применяется при пневмонии, дизентерии, сыпном и возвратном тифе, гонорее.
Форма выпуска: капсулы по 0,15 и 0,3 г.
Дата добавления: 2016-02-04 ; просмотров: 5215 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
663. Tetracyclini hydrochloridum
4-Диметил амино-1,4,4 а,5,5а,6,11,12а-октагидро-3,6,10,12,12а-пентаокси-6-метил-1,11-дикетонафтацен-2-карбоксамида
Тетрациклина гидрохлорид является солью тетрациклина основания, продуцируемого Streptomyces aureofaciens или другими родственными организмами или получаемого другими методами, и обладающего антимикробным действием.
Активность. Препарат должен содержать не менее 930 мкг/мг в пересчете на сухое вещество. Теоретическая активность тетрациклина гидрохлорида 1000 мкг/мг (ЕДмг). Один микрограмм химически чистого тетрациклина гидрохлорида соответствует специфической активности, равной одной единице действия (ЕД).
Описание. Желтый кристаллический порошок без запаха, горького вкуса. Водные растворы препарата становятся мутными при стоянии» вследствие осаждения основания тетрациклина.
Растворимость. Растворим в 10 ч. воды и 100 ч. 95% спирта.
Подлинность. К 0,05 г препарата прибавляют 2 мл концентрированной серной кислоты; появляется фиолетовое окрашивание, прибавляют 1 мл воды, окраска становится темно-желтой; при добавлении I капли раствора хлорида окисного железа окраска переходит в коричневую или красно-коричневую.
Препарат дает характерную реакцию на хлориды (стр. 747).
Удельное вращение от -239° до -258° в пересчете на сухое вещество (1% раствор препарата в 0,01 н. растворе соляной кислоты).
Оптическая плотность. 10 мл 0,01% раствора препарата в 0,01 н. растворе соляной кислоты вносят в мерную колбу емкостью 100 мл, прибавляют 75 мл воды и 5 мл 5 н. раствора едкого натра, доводят объем раствора водой до метки и перемешивают. Оптическую плотность (D) определяют при длине волны 380 нм в кювете с толщиной слоя в 1 см точно через 6 минут после добавления раствора едкого натра.
Оптическая плотность при длине волны 380 нм должна быть не менее 0,36 и не более 0,38.
Кислотность. рН 1,8-2,8 (1% водный раствор, потенциометрически).
Потеря в весе при высушивании. Около 2 г препарата (точная навеска) сушат в вакуум-сушильном шкафу при температуре 60° и остаточном давлении, не превышающем 5 мм рт. ст., в течение 3 часов. Потеря в весе не должна превышать 2%.
Испытание на токсичность. Тест-доза 1 мг активного вещества в пересчете на химически чистый тетрациклина гидрохлорид в объеме 0,5 мл воды, внутривенно (стр. 952). Срок наблюдения 48 часов.
Количественное определение. Биологическую активность препарата определяют методом диффузии в агар с тест-микробом Bacillus subtilis вариант Л2 (стр. 943).
Точность определения должна быть такова, чтобы доверительные пределы при Р = 95% отклонялись от среднего значения не более чем на ±5% (стр. 963).
Средняя величина найденной активности должна быть не менее 930 мкг/мг (EД/мг) в пересчете на сухое вещество.
Упаковка. В стеклянные, хорошо укупоренные банки оранжевого стекла с навинчивающимися крышками, залитыми парафином или мастикой, или в полиэтиленовые пакеты, вложенные в двойные пакеты, состоящие из полупергамента или пергамента и бумаги крафт, от 0,5 кг и выше активного вещества в пересчете на химически чистый тетрациклина гидрохлорид.
Хранение. Список Б. В сухом, защищенном от света месте, при комнатной температуре.
Высшая разовая доза внутрь 0,5 г.
Высшая суточная доза внутрь 2,0 г; см. также стр. 1034.
источник
Настоящая фармакопейная статья распространяется на лекарственный препарат тетрациклина гидрохлорид, таблетки (таблетки, покрытые пленочной оболочкой). Препарат должен соответствовать требованиям ОФС «Таблетки» и ниже приведенным требованиям.
Содержит не менее 90,0 % и не более 110,0 % от заявленного количества тетрациклина гидрохлорида C22H24N2O8·HCl.
Описание. Содержание раздела приводится в соответствии с требованиями ОФС «Таблетки».
1. ВЭЖХ. Время удерживания основного вещества на хроматограмме испытуемого раствора должно соответствовать времени удерживания тетрациклина на хроматограмме раствора стандартного образца тетрациклина гидрохлорида (раздел «Количественное определение»).
2. Качественная реакция. Препарат должен давать характерную реакцию на хлориды (ОФС «Общие реакции на подлинность»).
Растворение. Определение проводят в соответствии с ОФС «Растворение для твердых дозированных лекарственных форм» методом спектрофотометрии.
0,1 М раствор хлористоводородной кислоты;
Испытуемый раствор. Каждую корзинку, в которую помещают одну таблетку, погружают в сосуд для растворения с предварительно нагретой средой растворения. Через 45 мин отбирают пробу и фильтруют, отбрасывая первые порции фильтрата. Полученный раствор дополнительно разводят средой растворения до концентрации тетрациклина гидрохлорида 0,01 мг/мл.
Раствор стандартного образца тетрациклина гидрохлорида. В мерную колбу вместимостью 100 мл помещают около 0,1 г (точная навеска) стандартного образца тетрациклина гидрохлорида, растворяют в 0,1 М растворе хлористоводородной кислоты и доводят объём раствора тем же растворителем метки. В мерную колбу вместимостью 100 мл переносят 1,0 мл полученного раствора и доводят объем раствора 0,1 М раствором хлористоводородной кислоты до метки.
Раствор сравнения. Среда растворения.
Измеряют оптическую плотность испытуемого раствора и раствора стандартного образца тетрациклина гидрохлорида на спектрофотометре в максимуме поглощения при длине волны 353 нм в кювете с толщиной слоя 1 см.
Количество тетрациклина гидрохлорида, перешедшее в раствор, в процентах от заявленного количества (Х) вычисляют по формуле:
оптическая плотность испытуемого раствора;
оптическая плотность раствора стандартного образца тетрациклина гидрохлорида;
навеска стандартного образца тетрациклина гидрохлорида, мг;
содержание тетрациклина гидрохлорида в стандартном образце тетрациклина гидрохлорида, %;
фактор дополнительного разведения испытуемого раствора;
заявленное содержание тетрациклина гидрохлорида в одной таблетке, мг.
Через 45 мин в раствор должно перейти не менее 75 % (Q) тетрациклина гидрохлорида C22H24N2O8·HCl.
Родственные примеси. Определение проводят методом ВЭЖХ.
Подвижная фаза (ПФ). В мерную колбу вместимостью 1000 мл помещают 80,0 г 2-метил-2-пропанола, 200 мл воды, прибавляют 100 мл 35 г/л раствора дикалия гидрофосфата (доведённого до pH 9,0 10 % фосфорной кислотой), 200 мл 10 г/л раствора гидросульфата тетрабутиламмония (доведённого до pH 9,0 8,5 % раствором гидроксида натрия), 10 мл 40 г/л раствора эдетата натрия (доведённого до pH 9,0 8,5 % раствором гидроксида натрия) и объём раствора доводят водой до метки.
Испытуемый раствор. Точную навеску порошка растертых таблеток, содержащую около 0,1 г (точная навеска) тетрациклина гидрохлорида, помещают в мерную колбу вместимостью 100 мл, прибавляют 50 мл 0,01 М раствора хлористоводородной кислоты, перемешивают в течение 15 мин и доводят объем раствора тем же растворителем до метки, перемешивают и фильтруют.
Раствор стандартного образца тетрациклина гидрохлорида. В мерную колбу вместимостью 25 мл помещают около 25 мг (точная навеска) стандартного образца тетрациклина гидрохлорида, растворяют в 0,01 М растворе хлористоводородной кислоты и доводят объём раствора тем же растворителем до метки.
Раствор стандартного образца примеси A. В мерную колбу вместимостью 25 мл помещают около 10 мг (точная навеска) стандартного образца примеси A тетрациклина гидрохлорида, растворяют в 0,01 М растворе хлористоводородной кислоты и доводят объём раствора тем же растворителем до метки.
Раствор стандартного образца примеси C. В мерную колбу вместимостью 100 мл помещают около 10 мг (точная навеска) стандартного образца примеси C тетрациклина гидрохлорида, растворяют в 0,01 М растворе хлористоводородной кислоты и доводят объём раствора тем же растворителем до метки.
Раствор стандартного образца примеси D. В мерную колбу вместимостью 100 мл помещают около 10 мг (точная навеска) стандартного образца примеси D тетрациклина гидрохлорида, растворяют в 0,01 М растворе хлористоводородной кислоты и доводят объём раствора тем же растворителем до метки.
Раствор сравнения. В мерную колбу вместимостью 50 мл помещают 10,0 мл раствора стандартного образца примеси A, 5,0 мл раствора стандартного образца примеси C, 5,0 мл раствора стандартного образца примеси D и доводят объём раствора 0,01 М раствором хлористоводородной кислоты до метки.
Раствор для проверки разделительной способности хроматографической системы. В мерную колбу вместимостью 25 мл помещают 1,0 мл раствора стандартного образца тетрациклина гидрохлорида, 1,5 мл раствора стандартного образца примеси A, 10,0 мл раствора стандартного образца примеси D и доводят объём раствора 0,01 М раствором хлористоводородной кислоты до метки.
Примесь A: 4R,4aS,5aS,6S,2aS)-3,6,10,12,12a-пентагидрокси-4-(диметиламино)-6-метил-1,11-диоксо-1,4,4a,5,5a,6,11,12a-октагидротетрацен-2-карбоксамид, CAS 79-85-6.
Примесь С: (4S,4aS,12aS)-3,10,11,12a-тетрагидрокси-4-(диметиламино)-6-метил-1,12-диоксо-1,4,4a,5,12,12a-гексагидротетрацен-2-карбоксамид, CAS 1665-56-1.
Примесь D: (4R,4aS,12aS)-3,10,11,12a-тетрагидрокси-4-(диметиламино)-6-метил-1,12-диоксо-1,4,4a,5,12,12a-гексагидротетрацен-2-карбоксамид, CAS 7518-17-4.
25 Ч 0,46 см, силикагель октадецилсилильный, эндкепированный для хроматографии (С18), 5 мкм;
источник
В основе строения цефалоспоринов и полусинтетических цефалоспоринов лежат два соединения: 7-аминоцефалоспорановая кислота (7-АЦК) и 7-аминодезацетоксицефало-спорановая кислота (7-АДЦЕ), которые состоят из 2 конденсированных колец: β-лактамного (В) и метадигидротиазинового (А):
Цефалоспорины являются ацильными производными 7-АЦК или 7-АДЦК. Они являются более устойчивыми к действию β-лактамаз.
Первые сведения о цефалоспоринах относятся к 1945 г., когда итальянский микробиолог Brotzu при исследовании флоры морской воды близ берегов Сардинии обнаружил микроорганизмы с выраженной антибактериальной активностью. Развиваясь в питательной среде, эти организмы продуцируют вещество, ингибирую-щее развитие многих бактерий.
В 1948 г. было установлено, что изолированная Brotzu культура относится к виду Cephalosporium salmosynnematum и что она продуцирует 7 различных антибиотиков, одним из которых является цефалоспорин С.
Структура ядра цефалоспорина С сходна с таковой пенициллинов. Как оказалось, биогенез ядер этих типов антибиотиков идентичен; единственное исключение составляет способ замыкания серосодержащего кольца. У цефалоспорина С атом углерода, соответствующий одной из 2 метильных групп у С2-молекулы пенициллина, входит в состав шестичленного дигидротиазинового кольца.
Цефалоспорины — продукты метаболизма грибов Cephalosporinum. Они стали входить в медицинскую практику с 1960-х годов, и к настоящему времени используется большое число природных и полусинтетических антибиотиков этой группы.
Цефалоспорин С является трипептидом (состоит из валина, цистеина и α-аминоадипиновой кислоты):
Механизм их биодействия сходен с механизмом действия пенициллинов (ингибирование транспептидазы, участвующей в синтезе белковой оболочки патогенной бактерии). Структурно цефалоспорины подобны пенициллинам, но в них (3-лактамное кольцо конденсировано с шестичленным тиазиновым циклом. Если цефалоспорины первого поколения, такие как цефатриазин (35), цефазолин (36), цефалотин (44), цефалоридин (45) и др., эффективны против грамположительных бактерий, то представители второго поколения — цефаклор (37), цефуроксим (38) и др. -подавляют некоторые грамотрицательные бактерии (кишечную палочку и др.). Цефотаксим (39) и цефтриаксон (40) входят в группу бактерицидов третьего поколения. Они обладают еще более широким диапазоном биодействия и оказываются эффективными в борьбе с продуцентами лактамрасщепляющих ферментов пенициллиназ и цефалоспориназ (в начале 1990-х годов цефалоспорины (37)-(40) занимали ведущие места на мировом фармацевтическом рынке):
Сам цефалоспорин С не нашел широкого применения в каче-стве антибактериального средства. Однако его можно подвергнуть тем же модификациям, что и пенициллин. Ферментативное удаление боковой цепи (α-аминоадипиновой кислоты) приводит к образованию 7-АЦК, из которой путем химического ацилирования хлоранги-дридами кислот (по аналогии с полусинтетическими пенициллинами) можно получить различные полусинтетические цефалоспорины, примером которых является цефалотин (1962).
При отщеплении ацетоксигруппы в 3-м положении молекулы цефалоспорина С образуется 3-дезацетоксицефалоспорин С (имеет 20% активности цефалоспорина С). При удалении из 3-дезацетоксицефалоспорина С остатка α-аминоадипиновой кислоты образуется 7-АДЦК. Она может быть получена и из 7-АЦК при удалении ацетоксигруппы из 3-го положения.
На основе 7-АДЦК также получен ряд полусинтетических препаратов, например цефалексин.
В США в 1963 г. обнаружена химическая трансформация пенициллинсульфоксидов в дезацетоксицефалоспорановые производные (при нагревании в присутствии катализаторов):
Рентгеноструктурный анализ позволил установить иден-тичность пространственной структуры β-лактамных колец в пенициллинах и цефалоспоринах. Различие — в расположении экзоциклических карбоксильных групп. Поэтому разную активность и устойчивость пенициллинов и цефалоспоринов можно объяснить только различием стереоспецифичности карбоксильных групп, а также геометрии конденсированных циклических систем.
Кроме того, микробиологическая активность отдельных цефалоспориновых антибиотиков, полученных путем химической модификации природной молекулы, определяется типом дополнительно введенных заместителей.
Общая формула цефалоспоринов:
Получение:
Антибиотики цефалоспориновой группы син-тезируются на основе цефалоспорина С (41), получаемого ферментативным путем. В отличие от пенициллинов, в основном ядре которых допускается варьирование заместителей только по одному положению (6-аминогруппе), в случае цефалоспоринов возможны химические вариации как по 7-аминогруппе, так и по положению С-3, что позволяет синтезировать значительно более разнообразный арсенал лекарственных веществ. Цефалоспорин С (41) окисляют в системе NaOCl/HCOOH до иминолактона (42), который затем гидролизуют в 7-аминоцефалоспорановую кислоту (43). Эта кислота в свободном виде не может быть получена ферментативно, в отличие от аминопенициллановой кислоты (24), которую легко производят при ферментации в отсутствие ацилирующих ее карбоновых кислот. Далее проводят N-ацилирование аминокислоты (43) и модификацию ацетилоксиметильной группы в положении 3, получая различные антибиотики:
Синтез цефаклора значительно более многостадиен, что связано в основном со сложностью замены алкоксильной группы на хлор в положении 3 цикла.
Цефазолина натриевая соль-Cephazolinum natrium
Cвойства.
Порошок белого или белого с желтоватым оттенком цвета. Легко растворим в воде, изотоническом растворе, растворе глюкозы. Удельное вращение от –24,0 до – 15,0 в пересчете на сухое вещество (5% раствор препарата в 0.1 М растворе натрия гидроксида).
Получение.
Из 7-АЦК как описано выше.
Подлинность.
1.ВЭЖХ. в сравнении с ГСО цефазолина натриевой соли ВФС 42-2725-96.
2.ИК спектр.
3.УФ спектр 0,002% раствора препарата в 0.1 м растворе натрия гидрокарбоната должен иметь максимум поглощения при 272±2 нм и быть идентичным спектру ГСО.
4.Характерная реакция на натрий.
Примеси.
ТСХ, не более 1%. Методом ГЖХ определяют остаточные растворители и диметиланилин, триэтиламин и 2-этилгексановую кислоту.
Количественное определение.
1. ВЭЖХ в сравнении со стандартом.
Применение.
Антибиотик широкого спектра действия.
Форма выпуска.
Флаконы для приготовления раствора по 0,5 и 1,0 г.
Cвойства:
Порошок белого или белого с желтоватым оттенком цвета. Трудно и медленно растворим в воде, практически нерастворим в спирте, хлороформе. Удельное вращение от +149 до +158° (0,5% раствор в буферном растворе с рН 4,4).
Получение:
Представлено на схеме выше.
Подлинность:
1. ИК спектр.
2.ВЭЖХ в сравнении со ГСО цефалексина ФС 42-3122-95.
3.ТСХ.
4.УФ спектр в воде имеет максимум при 262 нм.
5.При добавлении к раствору цефалексина в 1% уксусной кислоте раствора сульфата меди и раствора едкого натра должно появиться зеленое окрашивание.
Примеси:
1.ВЭЖХ. Определяется содержание 7-АДЦК ( не более 1%) и фенилглицина (не более 1%). Любая другая неидентифицируемая примесь не должна превышать 1 %.
Количественное определение:
1. ВЭЖХ в сравнении с ГСО.
2. УФ спектрофотометрия при 262 нм.
Применение:
Антибиотик широкого спектра действия.
Форма выпуска:
Таблетки 0.5 г, капсулы 0.25 г.
Свойства:
Белый или слегка желтоватый кристаллический порошок. Мало растворим в воде, практически нерастворим в метаноле. Удельное вращение от +101 до +111° 1% раствор в 10г/л растворе соляной кислоты.
Получение:
Полусинтетический антибиотик.
Подлинность:
1. ИК спектр.
2. ВЭЖХ.
3.ТСХ.
4. УФ спектрофотометрия.
5.При нагревании на водяной бане смеси антибиотика с серной кислотой и формальдегидом появляется желто-коричневое окрашивание.
Примеси:
Примеси: фенилглицин, хлорпроизводное 7-АДЦК и еще 7 различных изомеров определяют ВЭЖХ. Суммарно не более 1%.
Количественное определение:
1.ВЭЖХ
Применение:
Антибиотик широкого спектра действия.
Форма выпуска:
Капсулы 0,25 и 0,5 г. порошок для оральной суспензии. 0,125 и 0,25 г. Таблетки, покрытые оболочкой
Свойства:
Белый или желтовато-белый кристаллический порошок. Гигроскопичен. Легко растворим в воде, 5% растворе глюкозы, трудно растворим в спирте этиловом. Удельное вращение от +59 до +66° 2% раствор в ацетатном буфере с рН 4,6.
Получение:
Как представлено выше на схеме.
Подлинность:
1. ИК спектр.
2. ВЭЖХ в сравнении со стандартным образцом.
3.УФ спектр 273 нм.
4.Дает качественную реакцию со смесью серной кислоты и формальдегида – красно-коричневая окраска.
5.Качественная реакция на натрий.
Примеси:
Сумма примесей не более 3% — метод ВЭЖХ. Остаточные растворители: метанол, этанол, хлористый метилен, ТГФ, 2-этилгексановая кислота. Реглмаентируются в качестве примесей 8 изомерных соединений.
Количественное определение:
1.ВЭЖХ.
2.УФ спектрофотометрия
Применение:
Антибиотик широкого спектра действия.
Форма выпуска:
Стерильный порошок 0.25, 0,75 1.5 г для приготовления раствора для инъекций.
Свойства:
Белый или желтовато-белый порошок. Гигроскопичен. Хорошо растворим в воде, слабо растворим в этаноле (95%). РН от 4,5 до 6.5. Удельное вращение от +58 до +64° 1% раствор в воде.
Получение:
По общей схеме синтеза.
Подлинность:
1. ИК спектр.
2.ВЭЖХ в сравнении с ГСО.
3.УФ спектр максимум 235 нм.
4.реакция на натрий.
Примеси:
ВЭЖХ: дезацетилцефотаксим не более 1%;
Дезацетокси цефотаксим не более 1% и некторые другие. Общее содержание примесей не более 3%, в т.ч. неидентифицированных не более 1%.
Количественное определение:
1. ВЭЖХ.
Применение:
Антибиотик широкого спектра действия.
Форма выпуска:
Порошок стерильный по 1 г и по 2 г.
Форма выпуска:
Порошок стерильный по 1-2 г.
Общие химические реакции на цефалоспорины:
Все цефалоспорины являются слабыми кислотами, некото-рые обладают амфотерными свойствами, некоторые образуют внутренние соли.
Общие химические свойства цефалексина и цефалотина обусловлены наличием в их составе молекул атома серы в дигидротиа-зиновом кольце (способность к окислению) и β-лактамного кольца (гидроксамовая реакция).
Реакцию окисления проводят 80% раствором H2SO4, содержащей 1% азотной кислоты. Цефалексин образует желтое окрашивание, цефалотина натриевая соль — оливково-зеленое, переходящее в красновато-коричневое.
Гидроксамовая реакция на β-лактамное кольцо проводится по методике для пенициллинов. Цефалотин, кроме того, дает гидрокса-мовую реакцию и на сложноэфирную группу:
Цефалексин (как и ампициллин, амоксициллин) содержит в ацильной части молекулы остаток α-фениламиноуксусной кислоты и поэтому дает реакцию с нингидрином (вишневое окрашивание) и сульфатом меди после нейтрализации раствором гидроксида натрия (оливково-зеленое окрашивание).
Среди общих методов количественного определения следует отметить:
1. Определение активности проводят микробиологическим методом диффузии в агар с тест-культурой Bacillus subtilis в сравнении со стандартными образцами препаратов.
2. Йодометрический метод проводится так же, как для солей бензилпенициллина, с применением ацетатного буфера рН 4,7 ± 0,05. Содержание цефалексина и цефалотина должно быть не менее 95,0% в пересчете на сухое вещество.
3. Для цефалексина-стандарта рекомендуется метод кислотно-основного титрования в неводной среде: растворяют вещество в муравьиной кислоте, затем добавляют ледяную уксусную кислоту и титруют потенциометрически раствором хлорной кислоты:
Ингибиторы β-лактамаз.
К этой группе относят два препарата – производное 1,1-диоксида пенициллановой кислоты – сульбактама натриевая соль и кислоту клавулановую.
Сульбактама натриевая соль
Свойства:
Белый или почти белый кристаллический поро-шок. Легко растворим в воде мало растворим в спирте этиловом. Удельное вращение от +205 до +235° (1% раствор в воде в расчете на сухое вещество).
Получение:
В доступной литературе не описано.
Подлинность:
1.ИК спектр.
2.ТСХ.
3.ВЭЖХ
4.УФ спектрофотометрия при 230 нм.
Примеси:
Суммарное содержание не более 3,5% методом ВЭЖХ.
Количественное определение:
1.УФ спектрофотометрия.
2.ВЭЖХ.
Применение:
Ингибитор бэта-лактамаз.
Форма выпуска:
В композициях с антибиотиками. Уназин – ампициллин натрий и сульбактам натрий 2:1.
Применение:
В композиции с антибиотиками как ингибитор бэта-лактамаз.
Основу химической структуры этой группы соединений составляет частично гидрированный тетрацен (нафтацен). Моле-кула тетрацена включает четыре конденсированных бензольных ядра:
Препараты группы тетрациклина имеют схожую структуру. Тетрациклины – полифункциональные соединения4 они содержат: фенольный гидроксил (пол.10); енольный гидроксил (пол. 3 и 12); диметиламиногруппу (пол.4); карбоксамидную группу (пол.2); метильную группу (пол.6); спиртовые гидроксилы (пол.6 и 12а); кетогруппы (1 и 11).
Все известные тетрациклины различаются заместителями в положениях 5 и 7.
Изучение антибиотиков тетрациклинового ряда началось в 1948 году, когда был выделен актиномицет Streptomyces aureofaciens и Streptomyces rimosus, продуцирующие антибиотик ауреомицин (хлортетрациклин). В 1952 году был получен аналог ауреомицина в нашей стране под названием биомицин. В 1950 году был выделен окситетрациклин или террамицин, в 1953 был описан тетрациклин. Эти соединения активны по отношению к грамположительным и грамотрицательным бактериям, механизм их действия обусловлен подавлением биосинтеза белков микробной клетки на уровне рибосом.
Получение природных тетрациклинов:
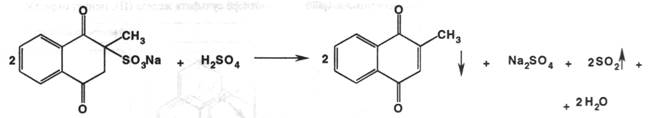
Природные тетрациклины: хлортетрациклин – он исключен из госреестра лекарственных средств, тетрациклин и окситетрациклин получают биосинтезом. Продуцентами являются модифицированные штаммы Streptomyces aureofaciens и Streptomyces rimosus. Полный синтез тетрациклина был осуществлен, однако в силу наличия нескольких хиральных атомов углерода получение природного вещества крайне сложно и экономически неоправдано. В настоящее время на производстве (АКО «Синтез» г.Курган) действует микробиологи-ческое производство тетрациклина. Впервые сам тетрациклин был получен гидрированием хлортетрациклина:
Общие свойства тетрациклинов:
Поскольку все известные тетрациклины близки по строению, близки и их свойства. В моле-куле тетрациклина имеются несколько ассиметрических центров: 4, 4а, 5, 5а, 6, 12а.
1. Кислотно-основные свойства:
Тетрациклины являются амфотерными соединениями. Диметиламиногруппа обладает основ-ными свойствами, поэтому тетрациклины образуют соли с органическими и неорганическими кислотами. Реакция используется при количественном определении — кислотно-основное титрование в неводных средах.
А) Как основание тетрациклины образуют соли:
За счет енольных и фенольных гидроксилов тетрациклины проявляют кислотные свойства и могут образовывать растворимые соли с гидроксидами щелочных металлов. Они также образуют нерастворимые окрашенные хелатные комплексы с поливалентными катионами.
Б) С едкими щелочами могут образовывать соли:
2. Наличие в молекуле тетрациклина двух цепей сопряжения обуславливает его интенсивную желтую окраску и соответственно интенсивные полосы поглощения в УФ спектрофотометрии:
3. Наличие фенольных гидроксилов в молекуле обуславли-вает реакции с хлорным железом и некоторыми другими метал-лами. Для идентификации тетрацикликов применяются реакции образования окрашенных солей с железа (III) хлоридом.
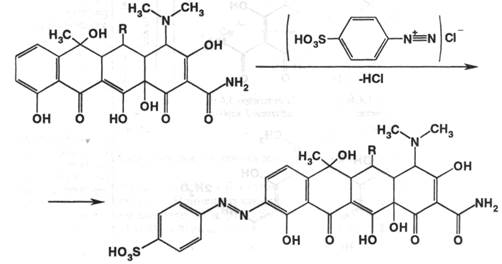
4. Кроме того, можно провести ряд реакций на фенольный гидроксил, например реакцию образования азокрасителя.
Тетрациклин растворяют в растворе гидроксида натрия и добавляют 1-2 капли соли диазония. Соль диазония из-за нестойкости готовят непосредственно перед проведением испытания, при этом используют соединения с первичной ароматической аминогруппой:
Данная реакция применяется для качественного и количественного анализа (метод ФЭК).
5. Реакция изомеризации под действием щелочи. В щелочной среде протекает изомеризация тетрациклинов с образованием окра-шенных в желтый цвет флюоресцирующих продуктов. Эта реакция используется для идентификации и спектрофотометрического коли-чественного определения тетрациклинов (Хмах = 380 нм):
В сильнокислой среде (например, при действии кислоты хлороводородной концентрированной) тетрациклины превра-щаются в ангидротетрациклины, которые имеют темно-желтую окраску (λ,мах = 437 нм) и желтую флюоресценцию в УФ-свете:
Для отличия тетрациклина от окситетрациклина используют концентрированную H2SO4. На 1-й стадии образуется ангидротетрациклин, а затем проходит реакция окисления с образованием окрашенных в различный цвет продуктов: тетрациклины — фиолетовое окрашивание, окситетрациклины — вишнево-красное.
Cвойства:
Желтый кристаллический порошок без запаха, горького вкуса. При хранении на свету темнеет. Очень мало растворим в воде, гидрохлорид лучше растворим, трудно растворим в спирте. Оптическое вращение от –260 до -280° 0,5% раствор в 0.1 М соляной кислоте.
Получение:
Биосинтез. Выделение экстракцией бутил-ацетатом или амилацетатом. Химочистка переосаждением и перекристаллизацией.
Подлинность:
1. ТСХ в сравнении со стандартным образцом (ФС 42-3313-96).
2.УФ спектр имеет несколько максимумов поглощения. В ФС вводится удельный показатель поглощения при 355 нм ( не менее 360 и не более 390).
3.ВЭЖХ.
Примеси:
Специфической контролируемой примесью явля-ются 4-эпитетрациклин и ангидротетрациклин. Определяют ВЭЖХ. Тетрациклины вследствие наличия ациклической структуры колец А, В, С, их молекул, а также фенольного гидроксила неустойчивы и в процессе хранения могут образовывать неактивные или токсич-ные продукты: 4-эпитетрациклины, которые необходимо учитывать при оценке качества. Эти примеси можно обнаружить методом ВЭЖХ или ТСХ с применением соответствующих стандартных образцов:
Поскольку тетрациклины являются токсичными продуктами, а методы очистки их недостаточны в отечественных ФС вводится показатель проверки на токсичность. Испытание проводится в соответствии с требованиями Х1 Фармакопеи, вып.2, стр.182. испытание проводят путем внутривенного введения тест-дозы белым мышам. Срок наблюдения 48 часов. В британской фармакопее такого теста нет.
Количественное определение:
1. Биологический метод диффузии в агар с тест культурой Bacillus subtilis в сравнении со стандартным образцом тетрациклина по ФС 42-3313-96.
2.ВЭЖХ ( Европейская фармакопея). Содержание действующего вещества от 88,0 до 102,0% в пересчете на сухое вещество.
3.Гравиметрический метод с пикриновой кислотой.
4.Фотометрический метод либо с арилстибниновой кистой или по образованию азо-красителя.
Применение:
Антибиотик.
Форма выпуска:
Таблетки 0,1 и 0,25 г, покрытые оболоч-кой. Гранулы для приготовления оральной суспензии. Раствор для инъекций. Мазь. Композитные таблетки с нистатином, олеандомицином.
Окситетрациклина дигидрат- Oxytetracyclini dihydras
Свойства:
Желтый или светло-желтый кристаллический порошок без запаха, горького вкуса. Гидрохлорид растворим в воде, дигидрат малорастворим в воде. Удельное вращение от –188 до -200° (1% раствор в 0.1 М соляной кислоте для дигидрата).
Получение:
Биосинтез.
Подлинность:
То же, что и для тетрациклина.
Примеси и количественное определение:
Аналогично тетрациклину.
Форма выпуска:
Мазь, аэрозоль (для гидрохлорида); таблетки, глазная мазь для дигидрата.
Метациклина гидрохлорид-Methacyclini hydrochloridum
Свойства:
Желтый кристаллический порошок без запаха, горького вкуса. Медленно растворим в воде.
Получение:
Получают из окситетрациклина окислительной дегидратацией:
Подлинность:
1.ИК спектр в сравнении со стандартным образцов..
2.ТСХ и ВЭЖХ.
3.УФ спектр имеет максимумы поглощения при 253 и 345 нм в смеси 0.1 М соляной кислоты и метанола (1:99).
4.Цветная реакция с конце6нтрированной серной кислотой (желтое окрашивание).
5.С хлорным железом (красно-коричневое окрашивание.
Примеси:
ВЭЖХ, контролируются исходный окситетрациклин и некоторые другие.
Количественное определение:
1. ВЭЖХ.
2.Биологический метод
Применение:
Более эффективный антибиотик.
Форма выпуска:
Капсулы 0,15 и 0,3 г.
Доксициклина гидрохлорид-Doxycyclini hadrochloridum
Свойства:
Желтый кристаллический порошок со слабым запахом этилового спирта. Очень мало растворим в воде и спирте. Растворим в водных растворах минеральных кислот и щелочей. Оптическое вращение от –113 до -130° 0,5% раствор в смеси 0,1 м раствора соляной кислоты и метанола (1:99). Получают согласно ФС 42-2545-88 в виде гемиэтанолата и гемигидрата.
Получение:
Полусинтетический антибиотик, получают из окситетрациклина восстановительной дегидратацией на родиевом катализаторе водородом или восстановление тиофенольного производного метациклина:
Подлинность:
1.ИК спектр в сравнении со стандартным образцом (ФС 42-2544-88).
2.ТСХ.
3.ВЭЖХ.
4.УФ спектрофотометрия. Максимум при 349 нм ( для безводной субстанци и).
5.С серной кислотой дает желтое окрашивание.
Примеси:
Контролируется по окситетрациклину, метациклину, 6-эпидоксициклину и 4-эпидоксициклину методом ТСХ или ВЭЖХ. Вводится испытание на токсичность.
Количественное определение:
1. ВЭЖХ (Британская фармакопея).
2.Тест-микроорганизмы методом диффузии в агар в сравнении со стандартным образцом.
Форма выпуска:
Капсулы по 0.05; 0,1 и 0,2 г.
источник